Metabolismo de compuestos nitrogenados
Metabolismo de aminoácidos
Procedencia.
- De proteínas de la dieta que se absorben y dan aminoácidos
- De proteínas funcionales de la célula que se recambian
Muchos aminoácidos se reutilizan para sintetizar proteínas. También pueden degradarse para obtener energía en los siguientes casos:
- Cuando se ingieren muchas proteínas
- Cuando hay déficit de glucosa y hace falta energía
Degradación
Hay 2 etapas:
- Desaminación, el grupo amino aparece en forma de NH4+ y queda el esqueleto carbonado
- Eliminación del grupo amino
El NH4+ es muy tóxico y los vertebrados terrestres lo eliminan transformándolo en urea que se excreta.
El esqueleto carbonado se transforma en 7 productos dependiendo del aminoácido.
Acetil-CoA, acetoacetatil-CoA, piruvato e intermediarios del C.A.C. (OAA, α OG, succinil-CoA y fumarato). Si hace falta energía se degradan en el C.A.C.
Si se ingieren muchas proteínas los esqueletos se almacenan en forma de ácidos grasos (grasas) o en forma de glucosa (glucógeno). Depende del destino del destino del esqueleto:
- Aminoácido cetogénicos: acetil-CoA, acetoacetato. Como no poseemos el ciclo del glioxilato no pueden producir glucosa
- Aminoácido glucogénicos: piruvato e intermediarios del C.A.C. dan lugar a glucosa
Degradación de aminoácidos
Se pierde el grupo amino. Actúa enzima glutamato transaminasa que quita el grupo amino y lo transfiere a un oxoácido. Casi todos los aminoácidos tienen el mismo oxoácido, el α OG que pasa a glutámico y el aminoácido forma un oxoácido:
Aminoácido2 + oxoácido1 ⟶ oxoácido2 + glutámico1
Tiene la ventaja de que todos los aminos están en el glutámico, se canalizan hacia la misma molécula. Algunos aminoácido lo ceden a la alanina, que es el oxoácido del piruvato:
Aminoácido + piruvato ⟶ oxoácido + alanina.
Si la alanina es el aminoácido2 todos se recogen en el glutámico.
| Alanina | H3+N—CH—COOH CH3 |
| Piruvato | O=C–COO¯ CH3 |
| Asparragina + piruvato ⟶ oxalacetato + alanina | |
| Asparragina: | H3+N—CH—COO¯ CH2 COO¯ |
| Oxalacetato: | O=C–COO¯ CH2 COO¯ |
Las transaminasas tienen como grupo prostético el fosfato de piridoxal (derivado de la vitamina B6) que sirve para transportar aminos. La Asp cede el amino al enzima que lo transporta en el piridoxal y luego lo cede al glutámico. Este sufre una desaminación oxidativa:
| Glutámico + NAD+ + H2O ⟶ | α-oxoglutarato + NH4+ + NADH |
| Glutamato deshidrogenasa |
El NH4+ puede usarse para sintetizar aminoácidos haciendo la reacción al revés por el mismo enzima que ahora depende de NADPH. Enzima regulado alostéricamente. La reacción de desaminación ocurre en todas las células.
Eliminación del NH4+
Si se absorbe el amonio en la sangre el α OG se convierte en glutámico y no habrán intermediarios del C.A.C. La transformación en algo inocuo ocurre en el hígado. Para transportar los NH4+ hasta allí se adhieren a la cadena lateral de la glutamina (es como el glutámico pero en lugar del grupo carboxilo tiene un amino):
| Glutámico + NH4+ + | ATP ⟶ | Glutamina + | ADP + | Pi |
| COO¯ | Glutamina sintasa | C=O | ||
| NH2 | ||||
Al llegar al hígado se hidroliza y suelta el grupo amino:
| Glutamina + H2O ⟶ | Glutámico + NH4+ |
| Glutaminasa |
Ciclo glucosa - alanina
Otra posibilidad de transporte hasta el hígado del NH4+ es que se recoja en forma de alanina, preferentemente en las células musculares:
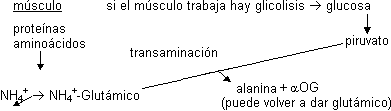
La alanina lo transporta por la sangre y en el hígado una transaminasa hace lo mismo al revés:

El piruvato puede ser para la gluconeogénesis y da glucosa que por la sangre vuelve al músculo.
Ciclo de la urea
Descubierto por Hans Adolf Krebs y Henseleit. Para eliminar el amonio se convierte en urea. Ocurre preferentemente en el hígado y se ven implicados enzimas mitocondriales y del citosol.
![]()
El CO2 procede de la atmósfera. Los NH2 vienen uno del amonio y otro del aspártico. Esta ruta requiere mucho ATP. En el citosol la arginina se hidroliza liberando urea y ornitina (aminoácido no proteico) por medio de la enzima arginasa.
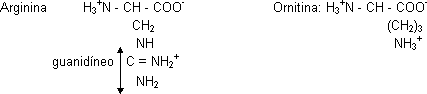
A partir de la ornitina se sintetiza arginina, la ornitina entra en la mitocondria y recibe el primer amino del glutámico por medio de la glutamato deshidrogenasa. En cuanto se forma el NH4+ reacciona con CO2 (en forma de HCO3¯, del C.A.C. …). Necesita 2 ATP, uno para la energía y otro para el fosfato. Aparecen 2 ADP + 1 Pi.
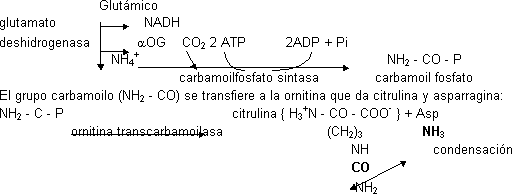
La citrulina es un aminoácido no proteico. La citrulina sale al citosol y recibe el segundo amino aportado por la Asp por reacción de condensación (el grupo amino de la Asp puede venir de cualquier aminoácido por medio de una transaminasa). Necesita 1 ATP. Se forma argininsuccinato. El ATP forma AMP. Una liasa rompe en Arg y fumarato (intermediario del C.A.C.).
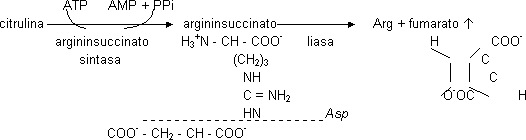
Balance neto:
NH4+ + Asp + HCO3¯ + 2 ATP + 2 ATP ⟶ urea + fumarato + 2 ADP + 2 Pi + AMP + PPi
Los 2 ATP es porque ATP ⟶ AMP es como si se gastaran 2 ATP.
Degradación del esqueleto carbonado
Al perder el grupo amino queda el oxoácido correspondiente al aminoácido. Hay 20 oxoácidos distintos que se convierten pasando por el C.A.C. en 7 intermediarios por medio de rutas convergentes: Acetil-CoA, acetoacetil-CoA, piruvato e intermediarios del C.A.C. (OAA, α OG, succinil-CoA y fumarato). Se usan para obtención de energía y fabricar glucosa. La leucina es el único que es sólo cetogénico. De los otros aminoácidos algún C aparecerá en forma de glucosa.
Biosíntesis de aminoácidos
Hay diferencias entre los organismos respecto a la capacidad de sintetizar aminoácidos y la fuente de N que usan. Un aminoácido se sintetiza uniendo el oxoácido correspondiente con NH4+. El hombre solo puede sintetizar 10 aminoácido, los otros son esenciales y se han de ingerir. La arginina es importante para neonatos, los adultos tienen bastante con la sintetizada en el ciclo de la urea.
Fuentes de N
El N es necesario además para la síntesis de purinas, pirimidinas y sus derivados. Todos los organismos pueden usar el NH4+ para formar enlaces C—N. La fuente más importante de N es el atmosférico, pero sólo algunos seres son capaces de sintetizar NH3, lo que es aprovechado por los demás.
Fijación de N2
Proceso por el cual el N atmosférico se convierte en una forma útil. Sólo pueden hacerlo procariotas, algunas bacterias y algas verdeazuladas (cianobacterias), y las leguminosas porque tienen una bacteria simbionte.
Reacción de fijación
Es como la reacción de síntesis industrial de NH3:
N2 + 3·H2 ⟶ 2·NH3 T = 500 °C, P = 300 atmósferas
El enzima nitrogenasa cataliza la reacción de reducción (necesitará e¯ y ATP). Es un enzima muy inestable y se inactiva en presencia de O2. Tiene 2 componentes, la nitrogenasa y una reductasa que recoge los e¯. Ambos tienen Fe, son ferroproteínas y la nitrogenasa tiene hemoglobina. La reacción global sí es conocida:
N2 + 8·e¯ + 8·H+ + 16 ATP ⟶ 2·NH3 + H2 + 16 ADP + 16 Pi
El ATP solo impulsa la reacción. Como el O2 inhibe la enzima las leguminosas fabrican una proteína en los nódulos donde están las bacterias que une covalentemente el O2, la leghemoglobina.
Ciclo del nitrógeno
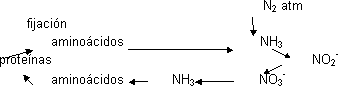
Una vez fijado el N2 otras bacterias lo oxidan para obtener energía transformándolo en nitrito y otras lo oxidan a nitrato. Estas son my abundantes y activas y todo el NH3 se transforma en NO3¯, lo que se llama nitrificación del suelo. El nitrato es usado por otras bacterias y plantas como fuente de nitrógeno. La planta vuelve a transformarlo en NH3 (desnitrificación). Esto es como una cadena de transporte electrónico donde el aceptor final es el NO3¯. El NH3 en las plantas se incorpora a los aminoácidos que forman proteínas que al ser degradadas vuelven a dar NH3. Sólo hay una entrada de N2, por fijación.
Biosíntesis de aminoácidos
Nosotros sólo podemos usar el NH4+ que viene de los aminoácidos. Para sintetizar aminoácidos necesitamos el oxoácido correspondiente y NH4+. El que da el amonio al oxoácido es el glutámico.
Incorporación del NH4+ al α OG. Es una reacción inversa a la de degradación de aminoácidos:
| NH4+ + α OG + NADPH ⟶ | Glutámico + NADP+ |
| Glutamato deshidrogenasa |
El glutamato por transaminación da el grupo amino a los aminoácidos.
Otra molécula importante es la glutamina:
| NH4+ + glutámico + ATP ⟶ | Glutamina + ADP + Pi |
| Glutamina sintasa |
Otra reacción que permite la síntesis directa de glutámico (dador glutamina):
| α OG + glutamina + NADPH ⟶ | 2 glutámico + NADP+ |
| Glutamato sintasa |
Por la acción secuencial de glutamina sintasa y glutamato sintasa se obtiene la misma reacción que NH4+ + α OG, pero se gastan 1 ATP y 1 NADPH. Esto es útil cuando la concentración de amonio es muy baja porque la glutamato deshidrogenasa tiene km para glutámico muy alta (ha de haber mucho glutámico). El glutámico puede ceder el amino a cualquier oxoácido:
![]()
Formación de los oxoácidos
Los aminoácidos se pueden agrupar en 6 familias atendiendo a su precursor. Son intermediarios de la glicolisis, C.A.C. y ruta de los fosfatos de pentosa. Piruvato (alanina), 3PG, OAA (aspártico), α OG (glutámico), R5P (histidina si hay ciclo del glioxilato) y eritrosa 4P.
Regulación
Preferentemente a nivel de glutamina sintasa. Enzima con muchos moduladores alostéricos (acumulativos) en los puntos de bifurcación para dar varios aminoácidos. También modulación covalente pero no por fosforilación. Puede inhibirse su síntesis (cambios en su concentración).
Autor: Sin datos
Editor: Ricardo Santiago Netto (Administrador de Fisicanet)