Aplicaciones industriales de la electrólisis
La descomposición electrolítica es la base de un gran número de procesos de extracción y fabricación muy importantes en la industria moderna.
Producción y Refinado de Metales
Soda Cáustica: la soda o sosa cáustica (un producto químico importante para la fabricación de papel, rayón y película fotográfica) se produce por la electrólisis de una disolución de sal común en agua. La reacción produce cloro y sodio. El sodio reacciona a su vez con el agua de la pila electrolítica produciendo sosa cáustica. El cloro obtenido se utiliza en la fabricación de pasta de madera y papel.
Horno Eléctrico: aplicación industrial importante de la electrólisis, que se utiliza para la producción de aluminio, magnesio y sodio. En este horno, se calienta una carga de sales metálicas hasta que se funde y se ioniza. A continuación, se deposita el metal electrolíticamente.
1) Aluminio: es el elemento metálico más abundante en la corteza terrestre. Es un metal poco electronegativo y extremamente reactivo. Se encuentra normalmente en forma de silicato de aluminio puro o mezclado con otros metales como sodio, potasio, hierro, calcio y magnesio, pero nunca como metal libre. La bauxita, un óxido de aluminio hidratado impuro, es la fuente comercial de aluminio y de sus compuestos.
Para la electrólisis del óxido de aluminio unido a la criolita (Na3AlF6) se emplean cubas de hierro recubiertas por carbón de retorta, que hace de cátodo y ánodos de grafito.
Primero se coloca en el interior de la cuba, criolita y se acercan los ánodos a las paredes de la cuba, de esta forma se genera un arco eléctrico (1.000 C°) que funde la criolita. Se añade entonces el óxido de aluminio y comienza la electrólisis. El cátodo se va consumiendo durante el proceso y aluminio fundido se deposita en el fondo de la cuba donde se retira por un orificio lateral, ubicado en la parte inferior de la misma.
Anodo:
6·O= + 3·C ⟶ 3·CO2 + 12·e¯
Cátodo:
4·Al+++ + 12·e¯ ⟶ 4·Al°
Reacción global:
2·AL2O3 ⇔ 4·AL+++ + 6·O=
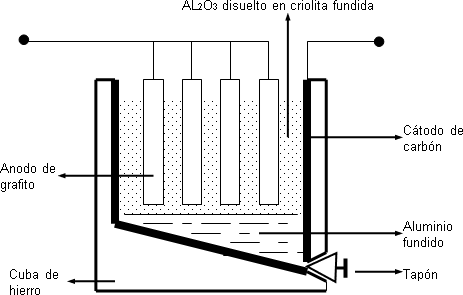
Esquema del refinado electrolítico del aluminio
Este proceso sigue siendo el método principal para la producción comercial de aluminio, aunque se están estudiando nuevos métodos. La pureza del producto se ha incrementado hasta un 99,5 % de aluminio puro en un lingote comercialmente puro; posteriormente puede ser refinado hasta un 99,99 por ciento.
La producción mundial de aluminio ha experimentado un rápido crecimiento, aunque se estabilizó a partir de 1.980. En 1.900 esta producción era de 7.300 toneladas, en 1.938 de 598.000 toneladas y en 1.993 la producción estimada de aluminio primario era de unos 19 millones de toneladas.
2) Manganeso: El manganeso puro se obtiene por la combustión del dióxido de manganeso (pirolusita) con polvo de aluminio y por la electrólisis del sulfato de manganeso. Este metal no se da en la naturaleza en estado puro, pero se encuentra ampliamente distribuido en todo el mundo en forma de menas. Ocupa el lugar 12 en abundancia entre los elementos de la corteza terrestre.
3) Sodio: Sólo se presenta en la naturaleza en estado combinado. Se encuentra en el mar y en los lagos salinos como cloruro de sodio, y con menor frecuencia como carbonato de sodio y sulfato de sodio. El sodio comercial se prepara descomponiendo electrolíticamente cloruro de sodio fundido. El sodio ocupa el séptimo lugar en abundancia entre los elementos de la corteza terrestre.
El método Downs para el refinado del sodio consta de un aparato que esta constituido por una caldera de hierro a, por cuya parte inferior entra un ánodo de grafito b. El cátodo C entra en la masa fundida de NaCl. Al circular una corriente por el cloruro de sodio fundido, se producen las siguientes reacciones.
Anodo:
2·Cl¯ - 2·e¯ ⟶ Cl2°
Cátodo:
2·Na+ + 2·e¯ ⟶ 2·Na°
Reacción global:
2·ClNa ⇔ 2·Na+ + 2·Cl¯
El sodio por su baja densidad, flota y se extrae por D mientras el cloro se desprende en E.
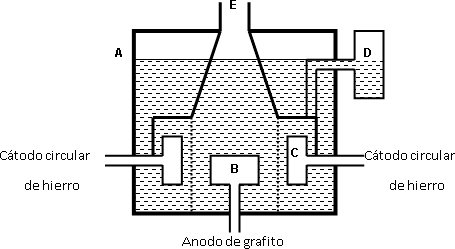
Esquema del refinado electrolítico del sodio
Refinado Electrolítico: estos métodos se utilizan para refinar el plomo, el estaño, el cobre, el oro y la plata. La ventaja de extraer o refinar metales por procesos electrolíticos es que el metal depositado es de gran pureza.
1) Plomo: Una fuente importante de obtención de plomo son los materiales de desecho industriales, que se recuperan y funden. El plomo en bruto suele purificarse removiendo plomo fundido en presencia de aire. Los óxidos de las impurezas metálicas suben a la superficie y se eliminan. Los grados más puros de plomo se obtienen refinando electrolíticamente.
2) Estaño: El estaño ocupa el lugar 49 entre los elementos de la corteza terrestre. El mineral principal del estaño es el SnO2 (casiterita). En la extracción de estaño, primero se muele y se lava el mineral para quitarle las impurezas, y luego se calcina para oxidar los sulfuros de hierro y de cobre. Después de un segundo lavado, se reduce el mineral con carbono en un horno de reverbero; el estaño fundido se recoge en la parte inferior y se moldea en bloques conocidos como estaño en lingotes. El metal obtenido se purifica por fusión, liberándolo de su principal impureza: el hierro, alcanza así una pureza del 90 %. Luego se lo refina electrolíticamente.
3) Cobre: El cobre puede encontrarse en estado puro, frecuentemente se encuentra agregado con otros metales como el oro, plata, bismuto y plomo, apareciendo en pequeñas partículas en rocas, aunque se han encontrado masas compactas de hasta 420 toneladas. Este metal puede galvanizarse fácilmente como tal o como base para otros metales. El cobre ocupa el lugar 25 en abundancia entre los elementos de la corteza terrestre.
La metalurgia del cobre varía según la composición de la mena. Las menas más importantes, las formadas por sulfuros, no contienen más de un 12 % de cobre, llegando en ocasiones tan sólo al 1 %, y han de triturarse y concentrarse por flotación. Los concentrados se funden en un horno de reverbero que produce cobre metálico en bruto con una pureza aproximada del 98 %. Este cobre en bruto se purifica posteriormente por electrólisis, obteniéndose barras con una pureza que supera el 99,9 %.
Para refinar el cobre bruto se emplea el método electrolítico. Se coloca al cobre bruto como ánodo, en una cuba electrolítica que contiene una solución de CuSO4. El sulfato cúprico se disocia de la siguiente forma:
CuSO4 ⇔ Cu++ + SO4=
El polo negativo o cátodo, esta constituido por láminas de cobre puro.
Al circular la corriente, los cationes cobre se dirigen al cátodo, donde se reducen, captando electrones y depositándose como cobre metálico, mientras los iones sulfato se dirigen al ánodo y reaccionan con el cobre impuro, formando sulfato cúprico, que vuelve a la solución.
Cátodo:
Cu++ + 2·e¯ ⟶ Cu°
Anodo:
SO4= - 2·e¯ ⟶ SO4°
Reacción global:
SO4 + Cu ⟶ CuSO4
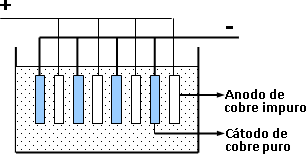
Esquema del refinado electrolítico del cobre
4) Oro: El oro se encuentra en la naturaleza en las vetas de cuarzo y en los depósitos de aluviones secundarios como metal en estado libre o combinado. Está distribuido por casi todas partes aunque en pequeñas cantidades, ocupando el lugar 75 en abundancia entre los elementos de la corteza terrestre. Casi siempre se da combinado con cantidades variables de plata.
El cianuro de oro y potasio se utiliza para el dorado electrolítico. El oro se extrae de la grava o de rocas trituradas disolviéndolo en disoluciones de mercurio (proceso de amalgama) o de cianuro (proceso de cianuro). Algunas menas, sobre todo aquéllas en las que el oro está combinado químicamente con teluro, deben ser calcinadas antes de su extracción. El oro se recupera de la solución electrolíticamente y se funde en lingotes. Para que una roca sea rentable debe contener un mínimo de una parte de oro por 300.000 partes de material desechable.
El oro puro es el más maleable y dúctil de todos los metales, puede golpearse con un martillo hasta conseguir un espesor de 0,000013 cm y una cantidad de 29 g se puede estirar hasta lograr un cable de 100 km de largo.
5) Plata: La plata ocupa el lugar 66 en abundancia entre los elementos de la corteza terrestre. No existe apenas en estado puro. La plata pura también se encuentra asociada con el oro puro en una aleación conocida como oro argentífero, y al procesar el oro se recuperan considerables cantidades de plata. La plata está normalmente asociada con otros elementos (siendo el azufre el más predominante) en minerales y menas. La plata también se encuentra como componente en las menas de plomo, cobre y cinc, y la mitad de la producción mundial de plata se obtiene como subproducto al procesar dichas menas. En 1.993, se produjeron en todo el mundo cerca de 13.000 toneladas.
Normalmente, la plata se extrae de las menas de plata calcinando la mena en un horno para convertir los sulfuros en sulfatos y luego precipitar químicamente la plata metálica. Hay varios procesos metalúrgicos para extraer la plata de las menas de otros metales. En el proceso de amalgamación, se añade mercurio líquido a la mena triturada, y se forma una amalgama de plata. Después de extraer la amalgama de la mena, se elimina el mercurio por destilación y queda la plata metálica. En los métodos de lixiviación, se disuelve la plata en una disolución de una sal (normalmente cianuro de sodio) y después se precipita la plata poniendo la disolución en contacto con cinc o aluminio. La plata impura obtenida en los procesos metalúrgicos se refina por métodos electrolíticos.
Tratamientos Anticorrosivos de Superficie
Son aquellos que impiden la corrosión cubriendo al metal que se desea proteger con una película adherente de un metal que no se corroa. La película puede ser construida con materiales variados: metálicos, inorgánicos u orgánicos. En este trabajo estudiaremos aquellos tratamientos que se realicen por medios electrolíticos.
Galvanotecnia
Proceso electrolítico por el cual se deposita una capa fina de metal sobre una base generalmente metálica. Los objetos además se galvanizan para obtener una superficie dura o un acabado atractivo. Los metales que se utilizan normalmente en galvanotecnia son: cadmio, cinc, cromo, cobre, oro, níquel, plata y estaño. Las cuberterías plateadas, los accesorios cromados de automóvil y los recipientes de comida estañados son productos típicos de galvanotecnia.
En este proceso, el objeto que va a ser cubierto actúa como cátodo en una cuba electrolítica que contiene una solución (baño) de una sal del metal recubridor, y se conecta a un terminal negativo de una fuente de electricidad externa. Otro conductor, compuesto por el metal recubridor, se conecta al terminal positivo de la fuente de electricidad actuando como ánodo. Para el proceso es necesaria una corriente contínua de bajo voltaje, normalmente de 1 a 6 V.
Cuando se pasa la corriente a través de la solución, los átomos del metal recubridor se depositan en el cátodo. Esos átomos son sustituidos en el baño por los del ánodo, si está compuesto por el mismo metal, como es el caso del cobre y la plata. Si no es así, se sustituyen añadiendo al baño periódicamente la sal correspondiente, como ocurre con el oro y el cromo. En cualquier caso, se mantiene un equilibrio entre el metal que sale y el metal que entra en la disolución hasta que el objeto está galvanizado. Los materiales no conductores pueden ser galvanizados si se cubren antes con un material conductor como el grafito. La cera o los diseños de plástico para la electrotipia, y las matrices de los discos fonográficos se recubren de esta manera.
Para asegurar una cohesión estrecha entre el objeto a ser recubierto y el material recubridor, se debe pulir bien la pieza y limpiar el objeto a fondo, eliminando polvo, grasa y suciedad, ya sea sumergiéndolo en una solución ácida o cáustica (después se lava y se introduce en la solución), o bien utilizándolo como ánodo en un baño limpiador durante un instante.
Para eliminar irregularidades en las depresiones de la placa y asegurar que la textura de su superficie es de buena calidad y propicia para el refinado, hay que controlar cuidadosamente la densidad de la intensidad de corriente (δ = i/s, donde S es la superficie del cátodo), la concentración de la solución y la temperatura. Con frecuencia se añaden al baño ciertos coloides o compuestos especiales para mejorar la uniformidad de la superficie de la placa.
Baño de Cromo: Es el baño electrolítico en el cual el cromo es el metal recubridor. El cromo tienen poco poder desprendedor, es decir, tienden a recubrir excesivamente las protuberancias y dejan las grietas del ánodo completamente desnudas. Al depositarse electrolíticamente, el cromo proporciona un acabado brillante y resistente a la corrosión. Debido a ello se emplea a gran escala en el acabado de vehículos.
Baño de Cadmio: Es el baño electrolítico en el cual el cadmio es el metal recubridor. El cadmio puede depositarse electrolíticamente en los metales para recubrirlos, principalmente en el hierro o el acero, en los que forma capas químicamente resistentes.
La electroquímica ha avanzado recientemente desarrollando nuevas técnicas para colocar capas de material sobre los electrodos, aumentando así su eficacia y resistencia. Tras el descubrimiento de ciertos polímeros que conducen la electricidad, es posible fabricar electrodos de polímeros.
Protección Catódica
La protección catódica de tuberías y cascos de buques se logra, formando pares Fe - Zn o Fe - Mg. En el caso de tuberías, se clavan barras de cinc o de magnesio en el suelo y se las pone en contacto con la tubería. Los electrones pasan del cinc al hierro de la tubería, el cual queda protegido. En los cascos de los buques, se adhieren bloques de magnesio. Estos bloques, debido a su mayor potencial de oxidación, se corroen, actuando como ánodo, protegiendo al hierro del casco. Dicha protección dura mientras no se consuma el magnesio. Llegado ese caso los bloques de magnesio son reemplazados.
Autor: Ricardo Santiago Netto. Argentina
¿Cuál es la aplicación de la electrolisis? ¿Para qué sirve la electrolisis?