La electrólisis y Faraday
Objetivos:
- Comprender el proceso de electrólisis;
- Leyes de Faraday
- Desarrollo:
Tomamos un vaso precipitado con NaOH dentro, y le colocamos dos electrodos cubiertos, cada uno, con dos buretas. Dentro de ellas, abriendo las correspondientes válvulas para permitir en ingreso de aire, dejamos subir sendas columnas de NaOH hasta un tope determinado por nosotros. Medimos estos volúmenes, anotándolos como datos iniciales (deben ser iguales, los de ambas buretas). Antes de enchufar la fuente, conectamos el miliamperimetro en serie con la fuente, para medir la corriente producida por la misma.
Una vez conseguidos los volúmenes de NaOH en las buretas, conectamos los electrodos a una fuente de 12 V corriente contínua. Esto provocará la electrólisis del NaOH.
Una vez conectada la fuente, y a intervalos de 60 segundos, medimos la corriente producida por la fuente, que nos servirá para poder calcular cuánto vale la constante de Faraday para el hidrógeno en este proceso.
Cuando empieza la electrólisis, veremos que el oxígeno se dirigirá hacia el ánodo de la fuente (produciéndose la oxidación de mismo) y el hidrógeno, se reducirá hacia el cátodo. Por lo tanto veremos como se traduce este proceso de electrólisis, en la diferencia de volúmenes de entre las buretas, quedando un volumen de aproximadamente el doble en el oxígeno.
- Presentación de Datos:
| Corriente (i) en ampere | Δt (segundos) | Medición N° |
|---|---|---|
| 0,29 0,30 0,31 0,30 0,30 0,31 0,305 0,29 0,30 0,29 | 60 60 60 60 60 60 60 60 60 60 | 1 2 3 4 5 6 7 8 9 10 |
Del cuadro anterior sacamos el promedio de la corriente, cuyo valor es:
imedia = 0,2995 A
• Volúmenes iniciales de las Buretas:
ViH2 = ViO2 = 47,4 cm³
• Volúmenes Finales de las Buretas:
VfH2 = 20,4 cm³
VfO2 = 33,5 cm³
Pero por Ecuación de los Gases tendremos que:
pgas = patmosférica - pv H2O
pgas = 0,97 atmósferas
Donde:
p·V = n·R·T
| n = | p·V |
| R·T |
Con nuestros datos:
| 0,97·101.325 Pa·(47,4 - 20,4) cm³· | 106 m³ | |
| nH2 = | cm³ | |
| (8,314 J/mol·K)·293 K | ||
nH2 = 1,0894·10-3 mol
De las Leyes de Faraday:
| m = | Eq·Q |
| F |
| 2·n·PM = | PM·Q |
| N°oxidación×F |
| F = | 1·Q |
| 2·n |
| F = | i·Δt |
| 2·n |
Entonces, con nuestros datos:
| FH2 = | 0,2995 A·600 s |
| 2·1,0894·10-3 mol |
FH2 = 82.479 C/mol
- Cuestionario sobre aspectos teóricos:
Pregunta n° 1
¿Cuál es la unidad de cantidad de electricidad, la de intensidad de corriente y la de diferencia de potencial en el Simela? ¿Cómo se define la resistencia de un conductor? Enuncie la Ley de Ohm.
Respuesta:
- La cantidad de cantidad de electricidad en el Simela es el coulomb (C), la de intensidad de corriente es el ampere (A) y la de diferencia de potencial es el volt (V).
- La resistencia en un conductor es una oposición por parte del material al traspaso de la corriente a través del mismo.
- Ley de Ohm: "Existe una cierta proporcionalidad entre la V y la i, definida como Resistencia, tal que si por un material eléctrico conductor circula una corriente de 1 A y está sometido a una diferencia de potencial de 1 V, dicho material presenta una resistencia de 1 W".
Pregunta n° 2
Dibuje esquemáticamente una celda electrolítica indicando sus distintos componentes. Indique el sentido de la corriente de electrones por el circuito externo y a través de la solución.
Respuesta:
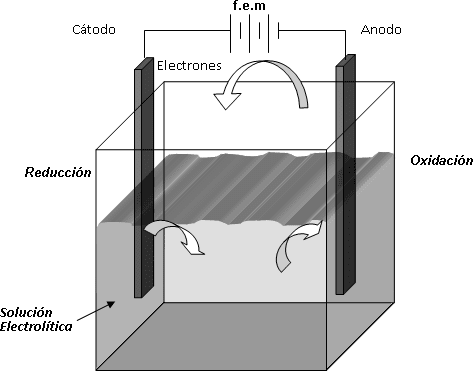
Circulación de electrones e iones en la electrólisis
Pregunta n° 3
¿Qué cantidad de electricidad representa la constante de faradio? ¿Cuál es su significado físico?
Respuesta:
Es la cantidad de corriente que se genera al transportar 1 mol de electrones de un elemento.
Pregunta n° 4
Calcule el valor de la constante de Faraday, partiendo del valor de la carga eléctrica del electrón y de la constante de Avogadro.
Respuesta:
Q = 1,6022·10-19 C
Na = 6,023·1023 particulas/mol
Como el faradio representa la cantidad de corriente para generar 1 mol de particulas (o electrones), entonces su valor será:
F = Q·Na
F = 1,602·10-19 C·6,023·1023 e/mol
F = 96.472,44 C/mol
Pregunta n° 5
Defina el equivalente químico. Escriba la expresión matemática que resume las leyes de Faraday.
Respuesta:
El equivalente electroquímico es la cantidad de masa (g) por unidad de cantidad de corriente (C), de la forma:
| E = | m |
| q |
| E = | Eq |
| F |
Las Leyes de Faraday se resumen en el cálculo de la masa de un elemento:
| m = | Eq·q |
| F |
Pregunta n° 6
¿Cómo puede verificar que circula corriente eléctrica a través de un electrolito? Dé varios métodos.
Respuesta:
- Poniendo un miliamperímetro en serie con la fem;
- Verificando que en el cátodo se deposite producto (por reducción)
Pregunta n° 7
Calcule el número de moles de hidrógeno y de oxígeno que se forman por electrólisis del agua, si la i = 100 mA, fem = 2 V y t = 10 min.
Respuesta:
q = i·t = 60 c
De donde, la electrólisis del H2O se produce como:
- Anodo (oxidación): 2·OH¯ ⟶ ½·O2 + H2O + 2·e¯
- Cátodo (reducción): 2·H+ + 2·e¯ ⟶ H2
Vemos que existen 2 electrones en juego en este proceso, por lo tanto en N° de oxidación será igual a 2, entonces:
| nH2 = | 60 C |
| 2·96.500 C/mol |
nH2 = 0,0003108 mol
Pero como por cada 1 mol de H2 se forma ½ mol de O2, entonces:
nO2 = ½·nH2
nO2 = 0,0001554 mol
Pregunta n° 8
¿Por que se usa corriente contínua y no alternada en los procesos de electrólisis?
Respuesta:
Pues los electrones variarían su sentido y no se llegaría a producir la electrólisis.
Pregunta n° 9
Calcule los volúmenes de hidrógeno y de oxígeno producidos en la electrólisis de una solución al 5 % de NaOH a 25 °C y 760 mm Hg, utilizando durante 40 minutos una corriente de 2 A.
Respuesta:
Disociación de la Solución:
NaOH ⟶ Na+ + OH¯ H2O ⟶ H+ + OH¯
Anodo (oxidación): 2·OH¯ ⟶ ½·O2 + H2O + 2·e¯
Cátodo (reducción): 2·H+ + 2·e¯ ⟶ H2
De los datos podemos calcular q de la forma:
q = i·t = 4.800 C
Entonces ahora calculamos la cantidad de moles para el H2:
| nH2 = | q | ·0,05 |
| 2·F |
nH2 = 1,24352·10-3 mol
De la ecuación de los gases:
| VH2 = | nH2·R·T |
| p |
VH2 = 608,432 cm³
Entonces:
VO2 = ½·VH2
VO2 = 304,216 cm³
Pregunta n° 10
¿Cuáles son los principales productos que se obtienen por electrólisis en la industria química?
Respuesta:
Principalmente aquellos metales con mayor potencial de reducción, como el Mg, Al, Na, etc.
- Cuestionario sobre aspectos experimentales:
Pregunta n° 1
Esquematice una celda electrolítica preparada para descomponer al agua de una solución diluida de NaOH, indicando los gases liberados en el anodo y cátodo, el sentido de circulación de los electrones y la reacción que ocurre en cada uno de los electrodos. ¿Por qué no se reduce el ion sódico en el cátodo?
Respuesta:
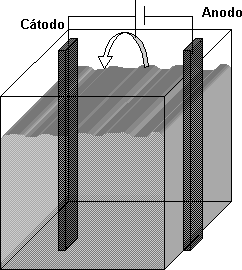
Esquema de una cuba electrolítica
Anodo (oxidación): 2·OH¯ ⟶ ½·O2 + H2O + 2·e¯
Cátodo (reducción): 2·H+ + 2·e¯ ⟶ H2
En el Cátodo no se reduce el Na+ debido a que es un metal alcalino, por lo tanto irá primero el H2 a liberarse, pues posee menor PM.
Pregunta n° 2
¿Cómo se calcula la masa del hidrógeno desprendido y el volumen correspondiente, conociendo el valor de la corriente y el tiempo de electrólisis? ¿Cómo identifica el cloro formado? ¿Sería posible la electrólisis empleando corriente alternada?
Respuesta:
Del valor de i y t sacamos q, el cual reemplazamos en la ecuación de Faraday:
| m = | Eq·q |
| F |
De donde:
| Eq = | PM |
| N° oxidación |
Pero como el N° de oxidación es equivalente a la cantidad de electrones que se intercambian en el proceso, entonces para este caso será igual a 2.
Generalizando:
| m = | q·PM |
| N°oxidación·F |
Por ecuación de los gases:
p·V = n·R·T
| VH2 = | mH2·R·T |
| PMH2·p |
Donde: p = patmosférica - pv
El cloro se identifica pues se evapora en el anodo (se oxida). No se podría hacer la electrólisis con alterna, pues los electrones cambiarían de sentido con el tiempo, con lo que el proceso no se llegaría a realizar.
Pregunta n° 3
¿A que se debe que los metales muy activos, como el Na y el K, se preparan por reducción electrolítica de sus sales?
Respuesta:
Debido a que son difíciles de reducir por su alto potencial, por lo tanto lo preparan por disolución en sales.
Pregunta n° 4
Calcule el error cometido en el calculo del volumen teórico de hidrógeno si se desprecia la corrección por presión de vapor del agua y por la columna de la misma. Para el cálculo considere que la columna de agua tiene una altura (h) de 20 cm y que se encuentra a 25 °C.
Respuesta:
| VH2a = | mH2·R·T |
| PM·p1 |
p1 = patmosférica = 1 atmósfera.
| VH2b = | mH2·R·T |
| PM·p2 |
p2 = patmosférica - pv
Entonces realizamos el cociente entre volúmenes, para verificar el error presente:
| VH2a | = | p2 |
| VH2b | p1 |
| VH2a | = | patmosférica - pv |
| VH2b | patmosférica |
| VH2a | = 1 - 1,9344·10-5 |
| VH2b |
Entonces quiere decir que el error cometido es del orden de 1,9344·10- 5
Autor: Mario Taguorian. España.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet)
Ejemplo de la aplicación de las leyes de Ohm y de Faraday a la electrólisis