Electroquímica, electrólisis y pilas (segunda parte)
Pilas voltaicas
Una pila que se utiliza como fuente de energía eléctrica se llama pila voltaica o galvánica en honor de Alessandro Giuseppe Volta (1.800) o Luigi Galvani (1.780), quienes primero experimentaron con la conversión de la energía química en energía eléctrica. La reacción entre cinc metálico y iones de cobre (II) en solución ilustra un cambio espontáneo en el cual se transfieren los electrones:
Zn(s) + Cu²⁺(AC) ⟶ Zn²⁺(AC) + Cu(s)
No se conoce el mecanismo exacto mediante el cual ocurre la transferencia de electrones. Sin embargo, podemos representar la reacción anterior como una combinación de dos medias reacciones:
Zn(s) ⟶ Zn²⁺(AC) + 2·e⁻
2·e⁻ + Cu²⁺(AC) ⟶ Cu(s)
En una pila voltaica, estas medias reacciones se realizan en electrodos diferentes de forma tal que la transferencia de electrones tiene lugar a través de un circuito eléctrico externo más bien que entre el cinc metálico y los iones de cobre (II).
La pila de la figura 5 esta diseñada para usar esta reacción para producir una corriente eléctrica. La media pila de la izquierda contiene un electrodo de cinc metálico y solución de ZnSO₄. La media pila de la derecha consiste en un electrodo de cobre metálico en solución de CuSO₄. Las medias pila están separadas por separador poroso que evita la mezcla mecánica de las soluciones pero permite el paso de iones bajo la influencia del flujo eléctrico. Una pila de este tipo se llama pila de John Frederich Daniell.
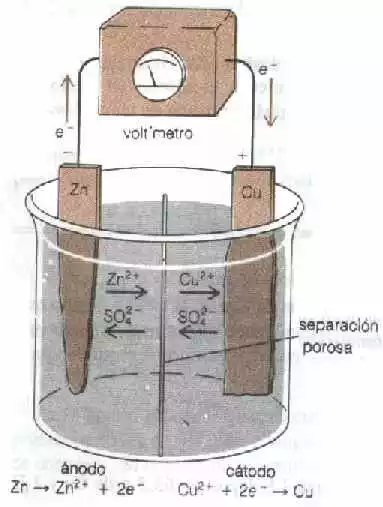
Figura "5" La pila de Daniell
Cuando los electrodos de cinc están unidos por un alambre metálico, los electrones fluyen del electrodo de cinc y cobre. En el electrodo de cinc, en cinc metálico se oxida a iones cinc. Este electrodo es el ánodo, y los electrones que son el producto de la oxidación abandonan la pila desde este polo. Los electrones se desplazan por el circuito externo hasta el electrodo de cobre, donde se utilizan en la reducción de los iones cobre (II) a cobre metálico. El cobre así producido se deposita sobre el electrodo. El electrodo de cobre es el cátodo. Aquí, los electrones entran a la celda y se realiza la reducción.
Puesto que los electrones se producen en el electrodo de cinc, este ánodo se designa como polo negativo. Los electrones se desplazan del polo negativo al polo positivo en el circuito externo de la pila voltaica cuando la pila esta en operación. El catado, donde los electrones se utilizan en el electrodo de reacción, es, por consiguiente, el polo positivo. Dentro de la pila, el movimiento de los iones completa el circuito eléctrico. A primera vista, es sorprendente que los aniones, que es el electrodo negativo. En la misma forma, los cationes, que transportan una carga positiva, se desplazan hacia el cátodo que el polo positivo.
Una cuidadosa consideración de las reacciones del electrodo provee la respuesta a este problema. En el ánodo se producen los iones cinc y los electrones permanecen en el metal. La neutralidad de la solución se mantiene en todo momento. En la solución que rodea el electrodo debe existir tanta carga negativa de los aniones como positiva de los cationes. Por esta razón, los iones SO₄⁼ se desplazan hacia el ánodo para neutralizar el efecto de los iones Zn⁼ que se producen. Al mismo tiempo, los iones cinc se alejan del ánodo hacia el cátodo. En el cátodo, los electrones se utilizan para reducir los iones Cu²⁺ a cobre metálico. Mientras que los iones Cu²⁺ se descargan, más iones Cu²⁺ se mueven hacia la región que rodea el cátodo para ocupar el lugar de los iones removidos. Si no ocurriera esto, se acumularía un exceso de iones SO₄⁼ alrededor del cátodo.
El separador poroso se agrega para evitar la mezcla mecánica de las soluciones de las dos medias pilas. Si los iones Cu²⁺ se pusieran en contacto con el electrodo del cinc metálico, Los electrones serian transferidos directamente en vez de pasar por el circuito. En la operación normal de la pila no ocurre este "cortocircuito" debido a que los iones Cu²⁺ se mueven en dirección distinta del electrodo de cinc. Realmente, esta pila trabajaría si una solución de un electrolito diferente del ZnSO₄ fuese utilizado en el comportamiento del ánodo y si un metal diferente del cobre fuese utilizado para cátodo. Sin embargo, los sustituyentes deben escogerse de tal forma que el electrolito en el comportamiento del ánodo no reaccione con el electrodo de cinc y el cátodo no reaccione con los iones Cu²⁺
Pila eléctrica
Mecanismo que convierte la energía química en eléctrica. Todas las pilas consisten en un electrólito (que puede ser líquido, sólido o en pasta), un electrodo positivo y un electrodo negativo. El electrólito es un conductor iónico; uno de los electrodos produce electrones y el otro electrodo los recibe. Al conectar los electrodos al aparato que hay que alimentar, llamado carga, se produce una corriente eléctrica.
Las pilas en las que el producto químico no puede volver a su forma original una vez que la energía ha sido convertida (es decir, que las pilas se han descargado), se llaman pilas primarias o voltaicas. Las pilas en las que el producto químico puede ser reconstituido pasando una corriente eléctrica a través de él en dirección opuesta a la operación normal de la pila, se llaman pilas secundarias o acumuladores.
Pila de dicromato

Pila de dicromato
Desarrollada en 1.850, la pila de dicromato consistía en electrodos de cinc y carbono situados en un frasco de cristal lleno de ácido crómico. El diseño de esta batería fue considerado mucho más seguro que el de sus predecesoras, pues no utiliza ácido nítrico concentrado que desprende humos venenosos.
Pilas primarias
La pila primaria más común es la pila Leclanché o pila seca, inventada por el químico francés Georges Leclanché en los años sesenta. La pila seca que se utiliza hoy es muy similar al invento original. El electrólito es una pasta consistente en una mezcla de cloruro de amonio y cloruro de cinc. El electrodo negativo es de cinc, igual que la parte exterior de la pila, y el electrodo positivo es una varilla de carbono rodeada por una mezcla de carbono y dióxido de manganeso. Esta pila produce una fuerza electromotriz de unos 1,5 V.
Otra pila primaria muy utilizada es la pila de cinc-óxido de mercurio, conocida normalmente como batería de mercurio. Puede tener forma de disco pequeño y se utiliza en audífonos, células fotoeléctricas y relojes de pulsera eléctricos. El electrodo negativo es de cinc, el electrodo positivo de óxido de mercurio y el electrólito es una disolución de hidróxido de potasio. La batería de mercurio produce unos 1,34 V.
La pila de combustible es otro tipo de pila primaria. Se diferencia de las demás en que los productos químicos no están dentro de la pila, sino que se suministran desde fuera.
Pilas secundarias
El acumulador o pila secundaria, que puede recargarse revirtiendo la reacción química, fue inventado en 1.859 por el físico francés Gaston Planté. La pila de Planté era una batería de plomo y ácido, y es la que más se utiliza en la actualidad. Esta batería que contiene de tres a seis pilas conectadas en serie, se usa en automóviles, camiones, aviones y otros vehículos. Su ventaja principal es que puede producir una corriente eléctrica suficiente para arrancar un motor; sin embargo, se agota rápidamente. El electrólito es una disolución diluida de ácido sulfúrico, el electrodo negativo es de plomo y el electrodo positivo de dióxido de plomo. En funcionamiento, el electrodo negativo de plomo se disocia en electrones libres e iones positivos de plomo. Los electrones se mueven por el circuito eléctrico externo y los iones positivos de plomo reaccionan con los iones sulfato del electrólito para formar sulfato de plomo. Cuando los electrones vuelven a entrar en la pila por el electrodo positivo de dióxido de plomo, se produce otra reacción química. El dióxido de plomo reacciona con los iones hidrógeno del electrólito y con los electrones formando agua e iones plomo; estos últimos se liberarán en el electrólito produciendo nuevamente sulfato de plomo.
Un acumulador de plomo y ácido se agota porque el ácido sulfúrico se transforma gradualmente en agua y en sulfato de plomo. Al recargar la pila, las reacciones químicas descritas anteriormente se revierten hasta que los productos químicos vuelven a su condición original. Una batería de plomo y ácido tiene una vida útil de unos cuatro años. Produce unos 2 V por pila. Recientemente, se han desarrollado baterías de plomo para aplicaciones especiales con una vida útil de 50 a 70 años.
Otra pila secundaria muy utilizada es la pila alcalina o batería de níquel y hierro, ideada por el inventor estadounidense Tomas Alva Edison en torno a 1.900. El principio de funcionamiento es el mismo que en la pila de ácido y plomo, pero aquí el electrodo negativo es de hierro, el electrodo positivo de óxido de níquel y el electrólito es una disolución de hidróxido de potasio. La pila de níquel y hierro tiene la desventaja de desprender gas hidrógeno durante la carga. Esta batería se usa principalmente en la industria pesada. La batería de Tomas Alva Edison tiene una vida útil de unos diez años y produce aproximadamente unos 1,15 V.
Otra pila alcalina similar a la batería de Tomas Alva Edison es la pila de níquel y cadmio o batería de cadmio, en la que el electrodo de hierro se sustituye por uno de cadmio. Produce también 1,15 V y su vida útil es de unos 25 años.
Pilas solares
Las pilas solares producen electricidad por un proceso de conversión fotoeléctrica. La fuente de electricidad es una sustancia semiconductora fotosensible, como un cristal de silicio al que se le han añadido impurezas. Cuando la luz incide contra el cristal, los electrones se liberan de la superficie de éste y se dirigen a la superficie opuesta. Allí se recogen como corriente eléctrica. Las pilas solares tienen una vida muy larga y se utilizan sobre todo en los aviones como fuente de electricidad para el equipo de a bordo.
Pila de combustible
Mecanismo electroquímico en el cual la energía de una reacción química se convierte directamente en electricidad. A diferencia de la pila eléctrica o batería, una pila de combustible no se acaba ni necesita ser recargada; funciona mientras el combustible y el oxidante le sean suministrados desde fuera de la pila.
Una pila de combustible consiste en un ánodo en el que se inyecta el combustible - comúnmente hidrógeno, amoníaco o hidracina - y un cátodo en el que se introduce un oxidante - normalmente aire u oxígeno. Los dos electrodos de una pila de combustible están separados por un electrólito iónico conductor. En el caso de una pila de combustible de hidrógeno-oxígeno con un electrólito de hidróxido de metal alcalino, la reacción del ánodo es 2·H₂ + 4·OH⁻ + 4·H₂O + 4·e⁻ y la reacción del cátodo es O₂ + 2·H₂O + 4·e⁻ + 4·OH⁻. Los electrones generados en el ánodo se mueven por un circuito externo que contiene la carga y pasan al cátodo. Los iones OH⁻ generados en el cátodo son conducidos por el electrólito al ánodo, donde se combinan con el hidrógeno y forman agua. El voltaje de la pila de combustible en este caso es de unos 1,2 V pero disminuye conforme aumenta la carga. El agua producida en el ánodo debe ser extraída continuamente para evitar que inunde la pila. Las pilas de combustible de hidrógeno-oxígeno que utilizan membranas de intercambio iónico o electrólitos de ácido fosfórico fueron utilizadas en los programas espaciales Gemini y Apolo respectivamente. Las de ácido fosfórico tienen un uso limitado en las instalaciones eléctricas generadoras de energía.
Actualmente se están desarrollando las pilas de combustible con electrólitos de carbonato fundido. El electrólito es sólido a temperatura ambiente, pero a la temperatura de operación (650 a 800 °C), es un líquido con iones carbonato conductores. Este sistema tiene la ventaja de utilizar monóxido de carbono como combustible, por lo que pueden utilizarse como combustible mezclas de monóxido de carbono e hidrógeno como las que se producen en un gasificador de carbón.
También se están desarrollando pilas de combustible que emplean dióxido de circonio sólido como electrólito. Estas pilas se llaman pilas de combustible de óxido sólido. El dióxido de circonio se convierte en un conductor iónico a unos 1.000 C. Los combustibles más adecuados son el hidrógeno, el monóxido de carbono y el metano, y al cátodo se le suministra aire u oxígeno. La elevada temperatura de operación de las pilas de combustible de óxido sólido permite el uso directo de metano, un combustible que no requiere catalizadores costosos de platino sobre el ánodo. Las pilas de combustible de óxido sólido tienen la ventaja de ser relativamente insensibles a los contaminantes del combustible, como los compuestos de azufre y nitrógeno que empeoran el rendimiento de otros sistemas de combustible.
La temperatura relativamente elevada de operación de las pilas de combustible de carbonato fundido y óxido sólido facilitan la eliminación en forma de vapor del agua producida por la reacción. En las pilas de combustible de baja temperatura se deben tomar medidas para eliminar el agua líquida de la cámara del ánodo.
Electrodo
Componente de un circuito eléctrico que conecta el cableado convencional del circuito a un medio conductor como un electrólito o un gas. El electrodo de carga positiva se denomina ánodo y el de carga negativa cátodo. La batería seca común utiliza un ánodo de carbono y un cátodo de cinc en contacto con una disolución electrolítica. Los electrodos de arco voltaico están fabricados con carbono y los electrodos empleados en la soldadura por arco están elaborados con un metal revestido de fundente. Los electrodos de los tubos de vacío están fabricados con carbono y diversos metales y aleaciones, según el uso al que estén destinados.
Fuerza electromotriz
Si se emplean soluciones de ZnSO₄ 1 M y CuSO₄ 1 M en la pila de Daniell, la pila puede representarse por los símbolos:
Zn(s) | Zn²⁺ (1 M) | Cu²⁺ (1 M) | Cu(s)
En los cuales las líneas verticales representan limites de fases. Convencionalmente, se escribe primero la sustancia que forma el ánodo. Los otros materiales de la pila se escriben en el orden en que uno los encuentra: del ánodo hacia el cátodo. La composición del cátodo se da como ultimo dato.
La corriente eléctrica se produce por una pila voltaica como resultado de la fuerza electromotriz (fem) de la pila, la cual se mide en volt. Entre mayor sea la tendencia a la cual ocurra la reacción de la pila, mayor será la fuerza electromotriz de la pila. Sin embargo, la fem de una pila dada también depende de la concentración de las sustancias utilizadas para hacer la pila.
La fuerza electromotriz estándar E se refiere a la fem de una pila a 25 °C, en la cual todo los reactivos y productos se hallan presentes en sus estados estándar. El estado estándar de un sólido o un líquido es, naturalmente, el sólido puro o el líquido puro. El estado estándar de un gas o una sustancia en solución es un estado definido de unidad de actividad ideal; o sea, se han aplicado correcciones para las desviaciones de lo ideal originadas por las atracciones intermoleculares e interionicas. Debido a una aproximación y dado por lo anteriormente explicado, una pila estándar contendría iones a concentraciones 1M y gases a 1 atmósfera de presión. En las celdas mencionadas más adelante, las concentraciones se indicaran solo si se desvían de lo estándar. Si la fuerza electromotriz de una pila se utiliza como medida de la tendencia para que ocurra la reacción de la pila, el voltaje debe ser el máximo valor obtenido para la pila en particular bajo consideración. Si existe un apreciable flujo de electricidad durante la medida, se reducirá el voltaje medido, E, debido a la resistencia interna de la pila. Además, cuando la pila distribuye corriente, las reacciones del electrodo producen cambios de concentración que reducen el voltaje.
Por consiguiente, la fem de una pila debe medirse sin flujo de electricidad apreciable a través de la pila. Esta medida esta acompañada por el uso de un potenciómetro. El circuito de un potenciómetro incluye una fuente de corriente de voltaje variable y un sistema para medir este voltaje. La pila bajo estudio esta conectada al circuito del potenciómetro en tal forma que la fuerza electromotriz de la pila se opone a la fem de la corriente del potenciómetro.
Si la fem de la pila es mayor que la del potenciómetro, los electrones fluirán en la dirección normal para descargar espontáneamente la pila de ese tipo. Por otra parte, si la fem de la fuente de corriente del potenciómetro es mayor que la de la pila, los electrones se moverán en la dirección opuesta, haciendo que la reacción de la pila se invierta. Cuando las dos fem están exactamente balanceadas, no fluirán los electrones. Este voltaje es la fem reversible de la pila. La fem de una pila estándar de Daniell es 1,10 V.
Las leyes de Faraday se aplican a las reacciones de las pilas voltaicas, como así también a las pilas electrolíticas. Sin embargo, debe observarse una precaución, la electricidad es producida por las simultaneas medias reacciones de oxidación y reducción que ocurren en el ánodo y el cátodo, respectivamente. Ambas deben realizarse si la pila va a producir corriente. Por lo tanto, se producirán dos faradays de electricidad por la oxidación de 1 mol de cinc en el ánodo junto con la reducción de 1 mol de iones Cu²⁺ en el cátodo. Las ecuaciones parciales son:
| Anodo | Zn | ⟶ | Zn²⁺ + 2·e⁻ |
| Cátodo | 2·e⁻ + Cu²⁺ | ⟶ | Cu |
Cuando se leen en términos de moles, representan el flujo de dos veces el número de Avogadro de electrones o la producción de 2 F de electricidad.
La cantidad de energía eléctrica en joule producida por unas pila es el producto de la cantidad de electricidad desprendida en coulomb, y la fem de la pila en volt. La energía eléctrica producida por la reacción entre 1 mol de cinc metálico y 1 mol de iones de cobre (II) se puede calcular como sigue:
2·96,5 C·1,10 V = 212,3 J
Un volt coulomb es un joule.
La fem utilizada en el cálculo anterior es la fem reversible (E °) de la celda estándar de Daniell y, por lo tanto, el voltaje máximo para esta pila. Por consiguiente, el valor obtenido es el trabajo máximo que puede obtenerse de la operación de este tipo de pila. El máximo trabajo neto (Algunas reacciones proceden con un aumento en volumen, y el sistema debe trabajar para expandirse contra la atmósfera para mantener constante la presión. La energía para este trabajo presion-volumen no esta disponible para ningún otro propósito, debe gastarse en esta forma si la reacción ocurre a presión constante. El trabajo presion-volumen no esta incluido en la medida potenciométrica del trabajo eléctrico de ninguna pila. El trabajo neto [o trabajo disponible] es un trabajo diferente al del trabajo presion-volumen) que puede obtenerse de una reacción química realizada a temperatura y presión constante es una medida de la disminución de la energía libre de Gibbs del sistema. Por consiguiente,
ΔG = -n·F·E
Donde n es el número de moles de electrones transferidos en la reacción (o el número de faradays producidos), F es el valor del faraday en las unidades apropiadas y E es la fem en volt. Si F se expresa como 96,485 C, ΔG se obtiene en joule. Un cambio en energía libre obtenido de la fem estándar, E, tiene el símbolo ΔG°.
El cambio de energía libre de una reacción es una medida de la tendencia de la reacción para efectuarse. Si se debe realizar un trabajo sobre un sistema para efectuarse un cambio espontaneo es aquel del cual se puede obtener trabajo neto. Por esta razón, para cualquier reacción espontanea, disminuye la energía libre del sistema; ΔG es negativo. Puesto que ΔG = -n·F·E, solo si E es positivo será espontanea la reacción de la pila y servirá como una fuente de energía eléctrica.
Galvanotecnia
Proceso electroquímico por el cual se deposita una capa fina de metal sobre una base generalmente metálica. Los objetos se galvanizan para evitar la corrosión, para obtener una superficie dura o un acabado atractivo, para purificar metales (como en la refinación electrolítica del cobre), para separar metales para el análisis cuantitativo o como es el caso de la electrotipia, para reproducir un molde. Los metales que se utilizan normalmente en galvanotécnia son: cadmio, cromo, cobre, oro, níquel, plata y estaño. Las cuberterías plateadas, los accesorios cromados de automóvil y los recipientes de comida estañados son productos típicos de galvanotécnia.
En este proceso, el objeto que va a ser cubierto se coloca en una disolución (baño) de una sal del metal recubridor, y se conecta a un terminal negativo de una fuente de electricidad externa. Otro conductor, compuesto a menudo por el metal recubridor, se conecta al terminal positivo de la fuente de electricidad. Para el proceso es necesaria una corriente contínua de bajo voltaje, normalmente de 1 a 6 V. Cuando se pasa la corriente a través de la disolución, los átomos del metal recubridor se depositan en el cátodo o electrodo negativo. Esos átomos son sustituidos en el baño por los del ánodo (electrodo positivo), si está compuesto por el mismo metal, como es el caso del cobre y la plata. Si no es así, se sustituyen añadiendo al baño periódicamente la sal correspondiente, como ocurre con el oro y el cromo. En cualquier caso, se mantiene un equilibrio entre el metal que sale y el metal que entra en la disolución hasta que el objeto está galvanizado. Los materiales no conductores pueden ser galvanizados si se cubren antes con un material conductor como el grafito. La cera o los diseños de plástico para la electrotipia, y las matrices de los discos fonográficos se recubren de esta manera.
Para asegurar una cohesión estrecha entre el objeto a ser recubierto y el material recubridor, hay que limpiar el objeto a fondo, ya sea sumergiéndolo en una disolución ácida o cáustica, o bien utilizándolo como ánodo en un baño limpiador durante un instante. Para eliminar irregularidades en las depresiones de la placa y asegurar que la textura de su superficie es de buena calidad y propicia para el refinado, hay que controlar cuidadosamente la densidad de la intensidad de corriente (ampere por metro cuadrado de superficie de cátodo) y la temperatura. Con frecuencia se añaden al baño ciertos coloides o compuestos especiales para mejorar la uniformidad de la superficie de la placa.
Algunos metales, en concreto el cromo, tienen poco poder desprendedor, es decir, tienden a recubrir excesivamente las protuberancias y dejan las grietas del ánodo completamente desnudas.
Destino final

¿Qué hacemos con las pilas?
E n cuanto al destino final de las pilas, no es posible hoy en el país, pensar en el reciclado, no quedando otra alternativa que el almacenamiento en condiciones controladas. Para las pilas alcalinas, no existe tecnología de reciclado desarrollada. En cuanto a las pilas de mercurio, que sí es posible reciclar, el problema es que el proceso es tremendamente costoso. A corto y mediano plazo, no se vislumbra otro método posible que sustituir los metales tóxicos por otros que no presenten peligros, pero las alternativas que hasta ahora se han manejado, no ofrecen una solución universalmente practicable. En Alemania, existe desde 1.986, un convenio entre el Ministerio de Medio Ambiente y los fabricantes, a fin de reducir el contenido de mercurio en las pilas. En España se busca una línea de pilas sin mercurio, y en diferentes países europeos se viene estudiando el problema relativo al poder contaminante que ellas poseen.
Las pilas no son inofensivas. Lo mejor es saber distinguir entre los distintos tipos de pilas que hay en el mercado y cuales son sus "contraindicaciones".
En la Argentina se venden 5 tipos de pilas no "recargables" compuestas por los siguientes minerales:
1) Carbón - cinc
2) Alcalinas
3) Cloruro de cinc
4) Óxido de plata
5) Óxido de mercurio
Las dos primeras son las más comunes; las usamos para radios, linternas, "walk-man", etc. Ambas contienen diferentes porcentajes de mercurio. Las otras tres también se venden mucho y son las baterías, botón de los relojes, calculadoras, cámaras de fotos. El porcentaje de óxido de mercurio en éstas puede llegar al 50 % de su peso total. En ambos grupos existe un elemento altamente contaminante: el mercurio. Cuando uno arroja pilas con mercurio a la basura, estas van a parar junto con el resto de los residuos a la tierra. Y a pesar de estar descargadas, seguirán descargando ese mineral a su alrededor. Si multiplicamos las pilas que usa cada habitante por la cantidad de habitantes, nos daremos cuenta con horror, cómo estamos contaminando nuestra tierra con mercurio. O sea, que la posibilidad de ingesta de este mineral no es un mal lejano. Puede provocar daños cerebrales, en los riñones y en la función motora. La mayoría (no todas) de las pilas y baterías "recargables" de ahora, carecen de mercurio. Sin embargo contienen níquel y cadmio, dos metales pesados altamente tóxicos. La exposición al níquel puede destruir los tejidos de las membranas nasales. Mientras los estudios sobre el cadmio, lo califican como cancerígeno y causante de trastornos en el aparato digestivo. Además de resultar altamente peligroso para las embarazadas.
Y entonces … ¿qué pilas convienen más?
Ninguna. Lo más conveniente es buscar otras fuentes de energía. Si tu radio también funciona con electricidad, dejá de lado las pilas. Si no hay más remedio que usarlas, te damos algunos consejos:
1) Usa pilas y baterías recargables. Estas pueden reemplazar a las alcalinas o a las de carbón - cinc en cualquier producto de alto consumo. Sus precios, claro, son más altos; pero a la larga, por ser recargables, saldrán más baratas. Sus fabricantes garantizan 1.000 recargas e incluso una duración para toda la vida. Al no tener que tirarlas después de un único uso, el daño ecológico es menor
2) Hay que comprar un aparato recargador de pilas (sirve para todas las marcas) y una vez que la pila está totalmente descargada, se les conecta por 3 horas y quedan como recién compradas
3) Jamás conectes una pila no-recargable al recargador, pueden explotar
¿Qué hacemos con las pilas, dónde tirarlas?
Pilas y baterías recargables no son una solución, pero si una buena alternativa. Lo más importante es buscar nuevas formas de consumo para tener energía.
Aquí van algunos consejos para ayudar al medio ambiente
Nunca mezcles pilas nuevas con usadas. Sólo lograrás reducir la vida útil de ambas, ya que las nuevas pasan su energía a las viejas.
- Busca pilas recargables de marcas reconocidas y que tengan impresa la leyenda: Libre de Mercurio (mercury free)
- Cuando vayas a comprar una calculadora o un reloj, recordá que existen los de "energía solar", y relojes que funcionan con nuestro pulso
Jamás hay que tirar las pilas al inodoro o al río. Tienen un altísimo poder de contaminación en el agua.
- No amontonar las pilas en un solo lugar. Es preferible desprenderse de ellas de a poco. Todas juntas son más peligrosas
- Nunca las quemes. Esta práctica puede tener un efecto nocivo inmediato para tu salud, porque se desprenden los vapores de los metales pesados
Tratamiento específico
Y a se ha explicado porqué las pilas no pueden ser colocadas con el resto de la basura de las casas, y mucho menos arrojarlas a cualquier sitio.
El Municipio de General Roca (Argentina), ha dispuesto el siguiente tratamiento final para las pilas recolectadas:
Se aplicará primeramente la denominada tecnología de estabilización, que consiste en eliminar sus características peligrosas por medio de reacciones químicas que reducen notablemente su solubilidad y movilidad, y eliminan prácticamente su toxicidad.
Para ello las pilas serán colocadas en bolsas plásticas, donde se colocará el correspondiente agente químico estabilizador. Luego las bolsas serán termoselladas.
Por lo general, los compuestos inorgánicos, son los de uso más extendido en las estabilización de estos residuos sólidos. Algunas reacciones típicas son:
a. Plomo
Agente de estabilización:
1) Hidróxido de calcio
2) Sulfuros de sodio
b. Ácido Sulfúrico
Agente de estabilización:
1) Hidróxido de sodio
c. Cadmio
Agente de estabilización:
1) Carbonato de sodio
d. Mercurio
Agente de estabilización:
1) Sulfuro de sodio, sulfuro de calcio
Las bolsas termoselladas, y con el estabilizador, serán colocadas en un repositorio especialmente acondicionado que limita totalmente la posible migración de contaminantes, pues los aísla y elimina la exposición a la lixiviación.
Este repositorio se ubicará la Norte del núcleo urbano en zona de bardas. El lugar será convenientemente señalizado.
Características del Repositorio
Las características básicas del repositorio, se pueden ver en la siguiente figura que representa un corte transversal del mismo:
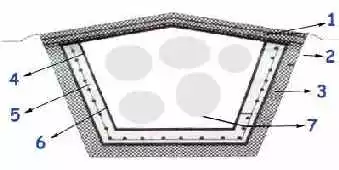
Repositorio de pilas usadas
1) Contrapiso de pendiente
2) Terreno natural compactado
3) Hormigón de limpieza
4) Polietileno de 200 micrones
5) Pared de hormigón armado
6) Membrana de polietileno de Alta densidad
7) Bolsas con pilas estabilizadas en masa de hormigón
El proceso planteado, evita mediante tres barreras de seguridad (estabilizador químico - bolsa de polietileno - repositorio) todo peligro de contaminación y asegura que esta situación se mantenga a lo largo del tiempo.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›