Propiedades físicas y químicas del gas natural
Propiedades físicas y químicas del gas natural
| Combustible | P.F. °C | P.E. °C | P.M. kg | Densidad kg/m³ | Poder Calorífico kcal/m³ | Calor de Combustión kcal/kg |
|---|---|---|---|---|---|---|
| Metano | -182,5 | -161,5 | 0,016 | 0,7175 | 9.024 | 13.187 |
| Etano | -183 | -87 | 0,030 | 1,3551 | 15.916 | 12.267 |
| Etileno | -169,4 | -103,8 | 0,028 | 1,26 | - | - |
| Propano | -189,9 | -42,1 | 0,044 | 2,0098 | 22.846 | 11.955 |
| n-butano | -138,3 | -0,5 | 0,058 | 2,7068 | 30.144 | 11.862 |
| i-butano | -145 | -10,2 | 0,058 | 2,7091 | 29.955 | - |
| n-pentano | -130 | 36 | 0,072 | 3,5066 | 38.149 | - |
| i-pentano | - | - | 0,072 | 3,4354 | 37.630 | - |
| Benceno | 5,5 | 80,1 | 0,078 | 890 | - | 10.026 |
| Ciclohexano | 6,55 | 80,74 | 0,084 | - | - | 11.167 |
Cuadro 2
Combustión
Es el proceso de oxidación rápida de un combustible acompañado de un aumento de calor y frecuentemente de luz. En el caso de los combustibles comunes, el proceso consiste en una combinación química con el oxígeno de la atmósfera que lleva a la formación de dióxido de carbono, monóxido de carbono y agua, junto con otros productos como dióxido de azufre, que proceden de los componentes menores del combustible.
A los combustibles gaseosos como el gas natural, el gas refinado o los gases manufacturados, se les añade aire antes de la combustión para proporcionarles una cantidad suficiente de oxígeno. La mezcla de aire y combustible surge del quemador a una velocidad mayor que la de la propagación de la llama, evitando así el retroceso de ésta al quemador, pero permitiendo el mantenimiento de la llama en éste. Estos combustibles, en ausencia de aire, arden con llamas relativamente frías y humeantes. Cuando el gas natural arde en el aire alcanza temperaturas que superan los 1.930 °C.
Las reacciones de combustión de los gases que nos interesan son las siguientes:
| Metano: | CH₄ + 2·O₂ ⟶ CO₂ + 2·H₂O |
| Etano: | 2·C₂H₆ + 7·O₂ ⟶ 4·CO₂ + 6·H₂O |
| Eteno: | C₂H₄ + 3·O₂ ⟶ 2·CO₂ + 2·H₂O |
| Propano: | C₃H₈ + 10·O₂ ⟶ 3·CO₂ + 4·H₂O |
| Butano: | 2·C₄H₁₀ + 13·O₂ ⟶ 8·CO₂ + 10·H₂O |
| Pentano: | C₅H₁₂ + 8·O₂ ⟶ 5·CO₂ + 6·H₂O |
| Benceno: | 2·C₆H₆ + 15·O₂ ⟶ 12·CO₂ + 6·H₂O |
| Ciclohexano: | C₆H₁₂ + 9·O₂ ⟶ 6·CO₂ + 6·H₂O |
Límites de inflamabilidad
El gas natural es susceptible de reaccionar con aire u oxígeno produciendo llama y gran cantidad de calor, el gas como combustible y el aire como comburente. La inflamación del gas depende de los limites de inflamabilidad, la temperatura de autoignición y la mínima energía para su inflamación.
Por ejemplo, una mezcla de gas y aire puede producir llama únicamente cuando la mezcla contiene una proporción de gas suficiente.
Para el gas natural, el (L.I.I.) limite inferior de inflamabilidad (5 %) es aquel hasta el cual la mezcla es pobre en combustible. Superado el (L.S.I.) limite superior de inflamabilidad (15 %) la mezcla pasa a tener un exceso de combustible. Entre ambos limites se encuentra toda la mezcla inflamable cuando además coincide una energía de activación.
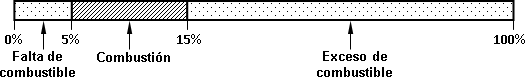
Esquema de los límites de inflamabilidad del gas natural
Si a presión atmosférica la temperatura aumenta el L.I.I. se reduce, en cambio el L.S.I. aumenta. Si a temperatura constante varia la presión, tenemos:
| Presión | 1,013 bar | 7 bar | 14 bar | 21 bar | 100 bar |
|---|---|---|---|---|---|
| L.I.I. | 5 % | 4,98 % | 4,93 % | 4,9 % | 4,6 % |
| L.S.I. | 15 % | 18 % | 24 % | 32 % | 50 % |
Cuadro 3
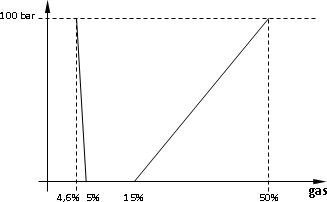
Gráfico 1: límites de inflamabilidad del gas natural a distintas presiones
Indice de octano
Los combustibles líquidos y gaseosos se clasifican en base a una escala conocida como índice de octano. El fundamento de esta escala es la propiedad de algunos combustibles a producir golpeteo en las máquinas de combustión interna.
Para clasificar un combustible se necesita una máquina normalizadora. Al heptano (C₇H₁₈) se le asigna arbitrariamente un índice de octano de cero y al 2,2,4-trimetilpentano un índice de octano de 100. La máquina normalizadora se pone a funcionar con el combustible que se prueba, así como con varias mezclas de los patrones. Cuando una de las mezclas de los dos combustibles de referencia causa el mismo efecto que el combustible de prueba, el ensayo concluye. El índice de octano del combustible de prueba es el correspondiente al porcentaje del 2,2,4-trimetilpentano de la mezcla con heptano.
Profesores: Arquitecto Costoya. y J. F. Aguirre
Autor: Anselmo Robles Bentham, Ricardo Santiago Netto, Osvaldo Daniel Pumar. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
Indice de octano. Yacimientos. Cuencas gasíferas