Aminoácidos y proteínas
Las proteínas están formadas por la combinación de 20 aminoácidos, estos varias de acuerdo a la estructura de sus radicales.
Cada aminoácido contiene un grupo amino (⁻NH₂) y un grupo carboxilo (⁻COOH) unidos a un átomo de carbono central. Un átomo de hidrógeno y el grupo lateral están también unidos al mismo átomo de carbono. Esta estructura básica es idéntica en todos los aminoácidos.
Los grupos laterales pueden ser no polares (sin diferencia de carga entre distintas zonas del grupo), polares pero con cargas balanceadas de modo tal que el grupo lateral en conjunto es neutro, o cargados, negativa o positivamente.
Los grupos laterales no polares no son solubles en agua, mientras que los grupos laterales polares y cargados son solubles en agua. A partir de estos relativamente pocos aminoácidos, se puede sintetizar una inmensa variedad de diferentes tipos proteínas, cada una de las cuales cumple una función altamente específica en los sistemas vivos.
Los aminoácidos se unen entre sí por medio de enlaces peptídico.
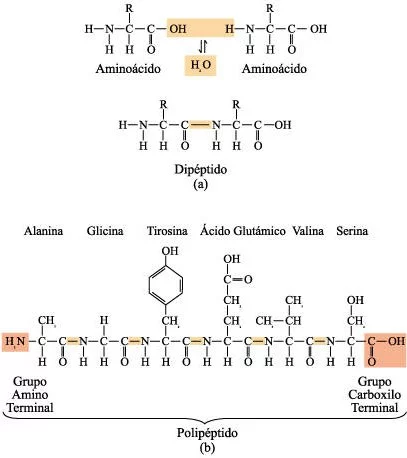
a) Un enlace peptídico es un enlace covalente formado por condensación. b) Los polipéptidos son polímeros de aminoácidos unidos por enlaces peptídico, en los que el grupo amino de un ácido se une al grupo carboxilo de su vecino. La cadena polipeptídica que se muestra contiene solamente seis aminoácidos, pero algunas cadenas pueden contener hasta 1.000 monómeros de aminoácidos.
La secuencia de aminoácidos se conoce como estructura primaria de la proteína y de acuerdo con esa secuencia, la molécula puede adoptar una entre varias formas. Los puentes de hidrógeno entre los grupos C=O y NH tienden a plegar la cadena en una estructura secundaria repetida, tal como la hélice alfa o la hoja plegada beta. Las interacciones entre los grupos R de los aminoácidos pueden dar como resultado un plegamiento ulterior en una estructura terciaria, que a menudo es de forma globular e intrincada. Dos o más polipéptidos pueden actuar recíprocamente para formar una estructura cuaternaria.
En las proteínas fibrosas, las moléculas largas entran en interacción con otras largas cadenas de polipéptidos, similares o idénticas, para formar cables o láminas. El colágeno y la queratina son proteínas fibrosas que desempeñan diversos papeles estructurales. Las proteínas globulares también pueden cumplir propósitos estructurales. Los microtúbulos, que son componentes celulares importantes, están compuestos por unidades repetidas de proteínas globulares, asociadas helicoidalmente en un tubo hueco. Otras proteínas globulares tienen funciones de regulación, de transporte y de protección.
Dada la variedad de aminoácidos, las proteínas pueden tener un alto grado de especificidad. Un ejemplo es la hemoglobina, la molécula transportadora de oxígeno de la sangre, compuesta de cuatro cadenas polipeptídicas (dos pares de cadenas), cada una unida a un grupo que contiene hierro (hemo). La sustitución de un determinado aminoácido por otro en uno de los pares de cadenas altera la superficie de la molécula, produciendo una enfermedad grave, en ocasiones fatal, conocida como anemia falciforme.
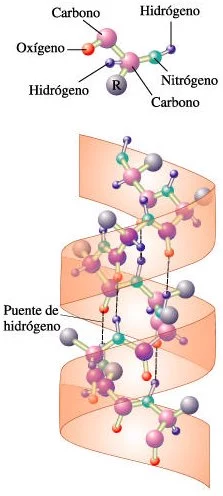
Estructuras secundarias de las proteínas: La hélice alfa
La hélice alfa: ésta hélice mantiene su forma por la presencia de los puentes de hidrógeno, indicados por las líneas de puntos. En este caso, los puentes de hidrógeno se forman entre los átomos de oxígeno del grupo carbonilo de un aminoácido y el átomo de hidrógeno del grupo amino de otro aminoácido situado a cuatro aminoácidos de distancia en la cadena. Los grupos R, que no se muestran en este diagrama, están unidos a los carbonos indicados por las esferas violetas. Los grupos R se extienden hacia afuera desde la hélice.
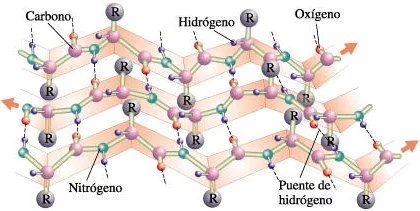
Estructuras secundarias de las proteínas: La hoja plegada beta
La hoja plegada beta, en la que los pliegues se forman por la existencia de puentes de hidrógeno entre distintos átomos del esqueleto del polipéptido; los grupos R, unidos a los carbonos, se extienden por encima y por debajo de los pliegues de la hoja.
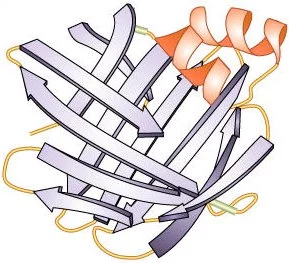
Diagrama de una proteína (enzima) cuya estructura secundaria incluye hoja beta plegadas (azul) y alfa hélices (roja)
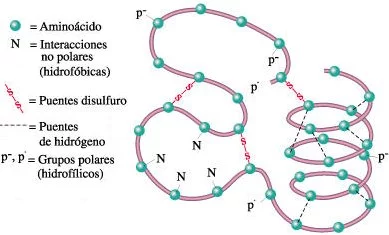
Tipos de enlaces que estabilizan la estructura terciaria de una molécula de proteína
Estos mismos tipos de enlace también estabilizan la estructura de las moléculas de proteínas formadas por más de una cadena polipeptídica.
Bibliografía:
- Apuntes de clase - Facultad de Agronomía - U.B.A
- Silvia R. Leicach. "Biomoléculas: estructura y rol metabólico". Segunda edición
- Helena Curtis - N. Sue Barnes. "Biología". Sexta edición en español
Autor: Diana Victoria Netto. Ingeniera Agrónoma. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).