Problema nº 4 de gases ideales, presión de un gas con el cambio de volumen - TP02
Enunciado del ejercicio nº 4
Un tubo cilíndrico de 1,5 m de largo se sumerge verticalmente en mercurio hasta que el extremo cerrado queda a 25 cm de la superficie libre del mercurio. Determinar la longitud que ocupará, dentro del tubo, el aire, si la presión exterior es de 75 cm de Hg (δ = 13,56 g/cm³).
Desarrollo
Datos:
l = 1,5 m
Δl = 25 cm = 0,25 m
p = 75 cm Hg
δ = 13,56 g/cm³
Convertimos las unidades de presión:
![]()
p = 99.991,7763 Pa
Convertimos las unidades de densidad:
![]()
δ = 13.560 kg/m³
Fórmulas:
![]()
Esquema:
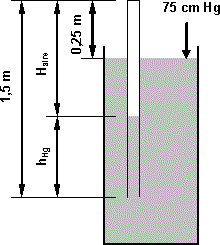
Esquema del barómetro
Solución
Aplicamos la ecuación general de los gases ideales. Para el caso:
p₁·V₁ = p₂·V₂
Pero el volumen es:
p₁·π·r²·h₁ = p₂·π·r²·h₂
Como la sección es uniforme:
p₁·h₁ = p₂·h₂
![]() (1)
(1)
Siendo:
h₁: 1,50 m
h₂: la altura buscada.
p₁: es la presión inicial, la atmosférica.
p₂: es la presión final, presión que el aire ejerce sobre el mercurio.
Según el esquema y el enunciado la presión en la boca del tubo es:
p = p₀ + δ·g·h
Donde:
p₀: es la presión atmosférica (p₁).
h: es la altura del mercurio (1,25 m).
Siendo g = 9,80665 m/s²
p = 99.991,7763 Pa + (13.560 kg/m³)·(9,80665 m/s²)·1,25 m
p = 266.214,494 Pa
Esta presión se encuentra equilibrada con la interna del tubo, que esta ejercida por el aire. Aplicando la ecuación (1):
![]()
Reemplazamos por los valores y calculamos:
![]()
Resultado, la longitud que ocupará el aire es:
h₂ = 0,5634 m
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular la presión de un gas con el cambio de volumen