Introducción a la Biología (Parte II)
Enlaces y moléculas
Cuando los átomos entran en interacción mutua, de modo que se completan sus niveles energéticos exteriores, se forman partículas nuevas más grandes. Estas partículas constituidas por dos o más átomos se conocen como moléculas y las fuerzas que las mantienen unidas se conocen como enlaces. Hay dos tipos principales de enlaces: iónico y covalente.
Los enlaces iónicos se forman por la atracción mutua de partículas de carga eléctrica opuesta; esas partículas, formadas cuando un electrón salta de un átomo a otro, se conocen como iones. Para muchos átomos, la manera más simple de completar el nivel energético exterior consiste en ganar o bien perder uno o dos electrones. Este es el caso de la interacción del sodio con el cloro que forma cloruro de sodio a través de un enlace iónico. Estos enlaces pueden ser bastante fuertes pero muchas sustancias iónicas se separan fácilmente en agua, produciendo iones libres.
Muchos iones constituyen un porcentaje ínfimo del peso vivo, pero desempeñan papeles centrales. El ion potasio (K⁺) es el principal ion con carga positiva en la mayoría de los organismos, y en su presencia puede ocurrir la mayoría de los procesos biológicos esenciales. Los iones calcio (Ca²⁺), potasio (K⁺) y sodio (Na⁺) están implicados todos en la producción y propagación del impulso nervioso. Además, el Ca²⁺ es necesario para la contracción de los músculos y para el mantenimiento de un latido cardíaco normal. El ion magnesio (Mg²⁺) forma parte de la molécula de clorofila, la cual atrapa la energía radiante del Sol en algunas algas y en las plantas verdes.
Los enlaces covalentes están formados por pares de electrones compartidos. Un átomo puede completar su nivel de energía exterior compartiendo electrones con otro átomo. En los enlaces covalentes, el par de electrones compartidos forma un orbital nuevo (llamado orbital molecular) que envuelve a los núcleos de ambos átomos. En un enlace de este tipo, cada electrón pasa parte de su tiempo alrededor de un núcleo y el resto alrededor del otro. Así, al compartir los electrones, ambos completan su nivel de energía exterior y neutralizan la carga nuclear, ésta unión se llama sigma σ o covalente simple.
Los enlaces iónicos, covalentes polares y covalentes en realidad pueden ser considerados como versiones diferentes del mismo tipo de enlace. Las diferencias dependen de los diferentes grados de atracción que los átomos que se combinan ejercen sobre los electrones. En un enlace covalente completamente no polar, los electrones se comparten por igual. Esos enlaces pueden existir sólo entre átomos idénticos: H₂, Cl₂, O₂ y N₂, por ejemplo. En los enlaces covalentes polares, los electrones se comparten de modo desigual, y en los enlaces iónicos hay una atracción electrostática entre los iones negativa y positivamente cargados, como resultado de que han ganado o perdido previamente electrones. Así, dependiendo de los átomos involucrados en la unión covalente, ésta tendrá o no carácter polar. Cuanto mayor sea la diferencia de electronegatividad entre los átomos que la componen mayor será la polaridad, hasta llegar a iónica en casos extremos.
Los átomos que necesitan ganar electrones para tener un nivel energético exterior completo y, por lo tanto, estable, tienen una fuerte tendencia a formar enlaces covalentes. Así, por ejemplo, un átomo de hidrógeno forma un enlace covalente simple con otro átomo de hidrógeno. También puede formar un enlace covalente con cualquier otro átomo que necesite ganar un electrón para completar su nivel de energía exterior.
La capacidad de los átomos de carbono para formar enlaces covalentes es de extraordinaria importancia en los sistemas vivos. Un átomo de carbono tiene cuatro electrones en su nivel energético exterior. Puede compartir cada uno de estos electrones con otro átomo, formando enlaces covalentes hasta con cuatro átomos. Los enlaces covalentes formados por un átomo de carbono pueden hacerse con cuatro átomos diferentes (los más frecuentes son hidrógeno, oxígeno y nitrógeno) o con otros átomos de carbono.
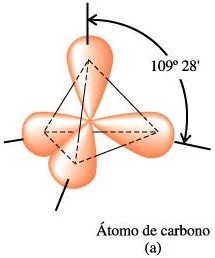
Orbitales del átomo de carbono.
Cuando un átomo de carbono forma enlaces covalentes con otros cuatro átomos, los electrones de su nivel de energía exterior forman nuevos orbitales. Estos nuevos orbitales, todos con una misma configuración, se orientan hacia los cuatro vértices de un tetraedro. Así, los cuatro orbitales se encuentran separados tanto como es posible.
El bloque estructural sobre el que se construyen las biomoleculas es el átomo de carbono tetravalente.
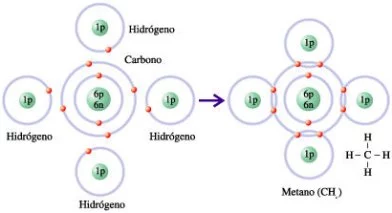
Reacción carbono-hidrógeno
Cuando un átomo de carbono reacciona con cuatro átomos de hidrógeno, cada uno de los electrones en su nivel de energía exterior forma un enlace covalente con el único electrón de un átomo de hidrógeno, produciéndose una molécula de metano.
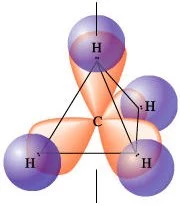
Representación tridimensional de la molécula de metano.
Los electrones que forman enlaces covalentes se mueven rápidamente formando orbitales complejos que engloban a los núcleos de hidrógeno y también al de carbono. Cada par de electrones se mueve en un orbital molecular nuevo.
Existen diferentes tipos de enlaces covalentes, entre ellos los enlaces covalentes polares y los enlaces covalentes simple σ, dobles π y triples π.
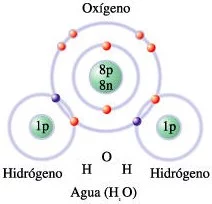
Dibujo esquemático de una molécula de agua (H₂O)
Cada uno de los dos enlaces covalentes sencillos de ésta molécula están formados por un electrón compartido del oxígeno y un electrón compartido del hidrógeno.
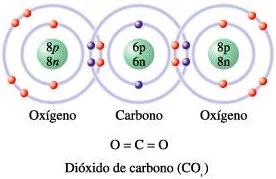
Esquema de la molécula de dióxido de carbono (CO₂)
El átomo de carbono en el centro de la molécula participa con dos enlaces covalentes dobles, uno con cada átomo de oxígeno. Cada enlace doble está formado por dos pares de electrones compartidos por los dos átomos que participan en el enlace. En las fórmulas estructurales el enlace doble se representa por dos guiones paralelos: =.
Reacciones químicas
La multitud de reacciones químicas que ocurren tanto en el mundo animado como en el inanimado pueden clasificarse en unos pocos tipos generales. Un tipo de reacción puede ser una combinación simple representada por la expresión:
A + B ⟶ AB
Ejemplos de este tipo de reacción son la combinación de los iones sodio y los iones cloruro para formar cloruro de sodio, y la combinación del gas hidrógeno con el gas oxígeno para producir agua.
Una reacción también puede ser de disociación:
AB ⟶ A + B
Por ejemplo, la ecuación anterior, que muestra la formación del agua, puede ocurrir en sentido inverso.
2·H₂O ⟶ 2·H₂ + O₂
Esto significa que las moléculas de agua producen los gases hidrógeno y oxígeno.
Una reacción también puede implicar un intercambio, tomando la forma:
AB + CD ⟶ AD + CB
Un ejemplo de dicho intercambio ocurre cuando los compuestos químicos hidróxido de sodio (NaOH) y ácido clorhídrico (HCl) reaccionan, produciendo sal de mesa y agua:
NaOH + HCl ⟶ NaCl + H₂O
Disposición de los electrones en algunos elementos familiares
| Elemento | Símbolo | N° atómico | N° de electrones en cada nivel de energía | |||
|---|---|---|---|---|---|---|
| 1° | 2° | 3° | 4° | |||
| Hidrógeno | (H) | 1 | 1 | — | — | — |
| Helio | (He) | 2 | 2 | — | — | — |
| Carbono | (C) | 6 | 2 | 4 | — | — |
| Nitrógeno | (N) | 7 | 2 | 5 | — | — |
| Oxígeno | (O) | 8 | 2 | 6 | — | — |
| Neón | (Ne) | 10 | 2 | 8 | — | — |
| Sodio | (Na) | 11 | 2 | 8 | 1 | — |
| Fósforo | (P) | 15 | 2 | 8 | 5 | — |
| Azufre | (S) | 16 | 2 | 8 | 6 | — |
| Cloro | (Cl) | 17 | 2 | 8 | 7 | — |
| Argón | (Ar) | 18 | 2 | 8 | 8 | — |
| Potasio | (K) | 19 | 2 | 8 | 8 | 1 |
| Calcio | (Ca) | 20 | 2 | 8 | 8 | 2 |
El primer nivel de energía puede contener un máximo de dos electrones, el segundo nivel un máximo de ocho, al igual que el tercer nivel energético de los elementos, hasta el Número Atómico 20 (calcio). En los elementos de mayor Número Atómico, el tercer nivel energético tiene orbitales internos adicionales, que pueden tener un máximo de diez electrones más. Como se puede observar, el cuarto nivel de electrones se empieza a llenar antes de completarse el tercero.
Bibliografía:
- Apuntes de clase - Facultad de Agronomía - U.B.A
- Silvia R. Leicach. "Biomoléculas: estructura y rol metabólico". Segunda edición
- Helena Curtis - N. Sue Barnes. "Biología". Sexta edición en español
Autor: Diana Victoria Netto. Ingeniera Agrónoma. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›