Problema nº 5 de calorimetría, cantidad de calor y calorímetro de masas - TP03
Enunciado del ejercicio nº 5
En un calorímetro con 500 g de agua a 18 °C se introducen 150 g de cobre a 100 °C. Si la temperatura final es de 20,2 °C, ¿cuál es el calor específico del cobre?
Desarrollo
Datos:
m₁ = 500 g (agua) = 0,50 kg
tᵢ₁ = 18 °C
m₂ = 150 g (cobre) = 0,15 kg
tᵢ₂ = 100 °C
tf = 20,2 °C
cₑ₁ = 1 kcal/kg·°C (agua)
Fórmulas:
Q = m·cₑ·(tf - tᵢ) (1)
Solución
En el equilibrio térmico la temperatura final de la mezcla obviamente es única:
tf1 = tf2 = tf
Para resolver el problema planteamos las ecuaciones de cantidad de calor (Q) para cada componente:
Q₁ = m₁·cₑ₁·(tf1 - tᵢ₁) (3) para el agua.
Q₂ = m₂·cₑ₂·(tf2 - tᵢ₂) (4) para el cobre
Debemos tener en cuenta que la temperatura final del cobre es menor que su temperatura inicial, por lo tanto:
Q₁ = m₁·cₑ₁·(tf - tᵢ₁) (3) para el agua.
Q₂ = m₂·cₑ₂·(tᵢ₂ - tf) (4) para el cobre
Planteamos el equilibrio:
Q₁ = Q₂
m₁·cₑ₁·(tf - tᵢ₁) = m₂·cₑ₂·(tᵢ₂ - tf)
Despejamos el calor específico del cobre (cₑ₂):
![]()
Reemplazamos por los datos:
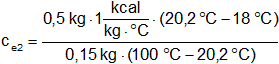
Hacemos las cuentas:
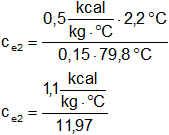
Resultado, el calor específico del cobre es:
cₑ₂ = 0,0912 kcal/kg·°C
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cálculos de cantidad de calor con calorímetro de masas