Estudio de las proteínas que unen O2
Mioglobina
Formada por una cadena polipeptídica. Necesita un cofactor (grupo prostético) para unir el O₂ sin el cual no es funcional. Este grupo es el hemo, formado por una parte orgánica derivada de las porfirinas llamada protoporfirina IX y una parte inorgánica esencial que es el Fe²⁺. Cada cadena tiene su grupo hemo. El hierro tiene 6 posiciones de coordinación, 4 con la protoporfirina con la cual forma un plano y otros dos, uno por encima y el otro por debajo. Uno de ellos se une a la cadena polipeptídica por medio de la histidina F8 (cadena F, posición 8) también llamada proximal porque está cerca del O₂. La otra histidina es la distal. Para que el hierro esté en forma de ferroso el entorno debe ser hidrofóbico, porque si hay agua pasa a férrico y la sexta posición de coordinación está ocupada por el agua y el O₂ no puede unirse. Sólo el grupo hemo une O₂, el resto de la proteína es para preservar el entorno hidrofóbico y que el Fe no se oxide completamente. Cuando el O₂ se une el Fe no es oxidado sino que se oxigena, porque el O₂ no cede completamente los electrones sino que cuando se va se los lleva.
Diferencias con la hemoglobina:
- La hemoglobina tiene 4 cadenas iguales dos a dos (dos α y dos β). Cada cadena es igual a la mioglobina (grupos hemo unidos a las mismas histidinas)
- La mioglobina tiene 1 cadena con 1 grupo hemo por lo que une 1 molécula de O₂
- La hemoglobina tiene 4 cadenas, 4 grupos hemo en total, por lo tanto, puede unir 4 moléculas de O₂
Unión del O₂
Mioglobina

A la presión parcial de O₂ que el 50 % de los sitios están ocupados se le llama P₅₀ y es una medida de la afinidad de la proteína por el ligando Si la P₅₀ sube la pO₂ debe ser alta para ocupar la mitad de los sitios, y si P₅₀ es baja es que tiene mucha afinidad.
Hemoglobina

Coeficiente de Hill, c = 2,8. Cooperatividad positiva muy alta. El primer O₂ se une con poca afinidad y el cuarto con afinidad varios órdenes de magnitud más alta. Prácticamente o está vacía o llena.
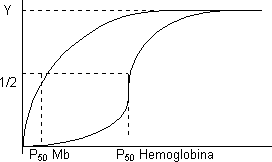
Gráfico de la función de saturación para hemoglobina y mioglobina
Representando Y para la mioglobina y la hemoglobina la asíntota está en 1. Se ve que la hemoglobina es menos afín porque está desplazada a la derecha. El P₅₀ de la mioglobina es mucho mayor que el de la hemoglobina (26 mm Hg). La hemoglobina como tiene 4 subunidades tiene menos afinidad por el O₂ que la mioglobina. La hemoglobina transporta el O₂ desde los pulmones o las branquias donde la pO₂ es muy alta. Si la pO₂ es alta las dos proteínas se saturan. Como la pO₂ es baja en los tejidos (20 - 30 mm Hg) al llegar la hemoglobina como está en torno a su P₅₀ libera el 50 % del O₂. Si la mioglobina estuviera en los eritrocitos no liberaría el O₂ porque a esa pO₂ tiene mucha afinidad. Por eso la hemoglobina es más adecuada para el transporte. Cuando la hemoglobina suelta el O₂ lo capta la mioglobina porque a esa pO₂ es favorable. Cuando la pO₂ en los tejidos baja lo libera la mioglobina.
Causa molecular de la cooperatividad
Como el índice de cooperatividad es alto podemos tener desoxihemoglobina u oxihemoglobina, pero las formas intermedias son poco importantes. Al ocupar el O₂ un grupo hemo los otros reaccionan produciendo un cambio conformacional que se comunica entre ellos por medio de la estructura cuaternaria. Las estructuras de la forma oxihemoglobina y la desoxihemoglobina son distintas. La forma T (desoxi) es más estable por la participación de puentes salinos de naturaleza iónica y muchos puentes de hidrógeno. Estas interacciones fijan la estructura e impiden la movilidad. La desoxihemoglobina se pliega dejando un hueco central entre la 4 subunidades. En la oxihemoglobina no hay puentes salinos y la cavidad es más pequeña (forma R).
La hemoglobina tiene dos cadenas α y dos β. Hay interacciones muy fuertes entre αβcomo si la molécula tuviera dos dímeros iguales. Cuando entra una molécula de O₂ se produce un cambio en la conformación y un dímero gira con respecto al otro 15°. La conformación de la forma con O₂ y la que no tiene por tanto no es la misma. El paso de la forma T a la R lo determina la entrada de O₂. Esto ocurre porque el O₂ se une al Fe del hemo de cada cadena, en la forma desoxi el Fe está por encima del plano que forma el grupo hemo unido a la histidina F8. Al unirse el O₂ y ocupar la sexta posición de coordinación el Fe pasa a tener 6 sustituyentes y reordena sus electrones colocándose en el centro del grupo hemo. Al moverse el Fe arrastra consigo a la histidina y ésta por medio de la hélice a toda la molécula. Por ello un grupo hemo se comunica con otro por medio de la cadena polipeptídica. Al cambiar la conformación los grupos que formaban los puentes salinos ya no estarán enfrentados y no interaccionarán. La entrada de la primera molécula de O₂ será más difícil porque se una a la forma T con lo cual es más difícil mover el Fe hacia el plano del hemo por impedimentos de tipo estérico entre la histidina y la valina del grupo hemo. Cuando se une el O₂ la tensión es grande en la molécula y se rompen puentes salinos, la proteína pasa a la forma R y la unión de O₂ es más favorable.
Otros ligandos que pueden unirse a la hemoglobina
La hemoglobina puede unir otros ligandos que afecten a la unión del O₂ (efecto heterotrópico). Su efecto es la disminución de la afinidad de la hemoglobina por el O₂
Protones: se unen a grupos que se estén disociando a pH celular. Los grupos afectados en la hemoglobina son el imidazol de la histidina y los 4 α-amino. Al aumentar la concentración de protones disminuye la afinidad y la curva de υ se desplaza a la derecha. Como consecuencia del metabolismo aumenta la concentración de protones en los tejidos periféricos y cuando la hemoglobina llega disminuye su afinidad por el O₂ y los suelta. Los protones se unen a los grupos que formaban el puente salino que al protonarse vuelven a formarlo pasando a la forma T. Al aumentar luego el pH se desprotonan y se rompen los puentes salinos. La primera molécula de O₂ rompe más puentes salinos que la segunda por lo que la cooperatividad es positiva. Los protones no se unen al hemo, sino a otros grupos que son importantes porque determinan en parte la conformación.
CO₂: el CO₂ es la forma más oxidada del C, es un producto final del metabolismo. Su concentración aumenta en los tejidos donde se degrada la materia orgánica. Se transporta en forma de ácido carbónico disuelto en la sangre hasta los pulmones donde se intercambia. Está disociado en HCO₃⁻ y H⁺. Esos protones tienen efecto sobre la afinidad del O₂. El CO₂ se une a la hemoglobina por medio del α-amino de la cadena polipeptídica:
![]()
Esta reacción da lugar a carbamatos que favorecen la formación de más puentes salinos al introducir la carga negativa (se da sólo en la forma desoxi). La hemoglobina o tiene unidos H⁺ y CO₂ o tiene el O₂:
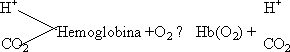
Efecto Bohr: Efecto conjunto de H⁺ y CO₂ sobre la afinidad de la hemoglobina por el O₂. En los tejidos se producen H⁺ y CO₂ y el pH baja. Hay tendencia a que la hemoglobina suelte el O₂. En los pulmones la presión parcial de O₂ es alta por lo que se capta el O₂ y se eliminan H⁺ y CO₂ pasando a la forma oxihemoglobina.
2,3-Bifosfoglicerato (2,3-BPG): está cargado a pH fisiológico:
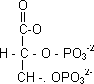
Presente en alta concentración en la sangre, comprable a la de la hemoglobina. Es un ligando que se une a la hemoglobina en proporción 1:1 por medio de la cavidad central del tetrámero. Tendrán que haber muchas cargas positivas para estabilizarlo, uniéndose a ellas iónicamente. Para soltarlo habrá que romper los enlaces iónicos por medio de energía. En la forma oxihemoglobina el hueco central es más pequeño y el 2,3-DPG no cabe. El efecto que produce es la disminución de la afinidad porque aporta interacciones extra que hay que romper para pasar a la forma oxi. Aumenta la cooperatividad desplazando la curva de υ a la derecha.
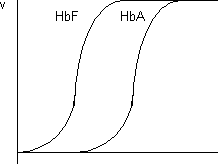
Significado fisiológico: La sangre se acomoda a diferentes presiones parciales de O₂ modificando la concentración de 2,3-DPG de modo que cuanta menos PO₂ más aumenta la concentración de 2,3-DPG. Esto es para que la hemoglobina pierda bastante afinidad por el O₂ para que lo libere a una PO₂ menor. Otro efecto es la oxigenación de la hemoglobina fetal, que tiene composición distinta a la de los adultos. La HbA (adultos) tiene α₂ β₂ y la HbF es α₂ γ₂. La diferencia estriba en la secuencia de aminoácidos. La HbF debe tener más afinidad por el O₂ que la HbA que la nutre. En la cadena γ un residuo de histidina cargada positivamente es sustituido por una serina (no cargada). Al eliminar una carga positiva el 2,3-DPG se une peor y es más fácil pasar a la forma oxiHb.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).