Cinética enzimática
Cinética de Michaelis - Menten
Las reacciones enzimáticas se caracterizan porque aunque se aumente la concentración de sustrato la velocidad no aumenta linealmente, aparece un efecto de saturación. La saturación se debe a que todos los centros activos están ocupados. La velocidad depende de la cantidad de enzima con sustrato suficiente. Consideraremos sólo la velocidad inicial de las reacciones para cada concentración de sustrato cuando se construya una gráfica, evitando el error introducido por el deterioro de la enzima. Como en el primer momento no hay producto no consideraremos la reacción contraria.
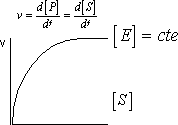
La velocidad depende de una constante de velocidad K y de su inversa:
K₁ K₂
ES + S ⇌ ES ⇌ ES + P
K₋₁ K₋₂
El paso limitante en la velocidad es K₂, por lo tanto, la expresión de la velocidad será:
v = K₂·[S]
Donde K₂ también recibe el nombre de KCAT. La concentración de enzima será mucho menor que la de sustrato porque no se consume.
Los enzimas que siguen esta cinética se dice que siguen la cinética de Michaelis - Menten.
Al aumentar la concentración de enzima la gráfica es igual pero por arriba.
Ecuación de velocidad de Michaelis - Menten
La concentración de sustrato libre será prácticamente la concentración inicial porque la cantidad de enzima es muy pequeña. Haremos las siguientes consideraciones:
- S₀ = [S] + [SE] donde [SE] puede despreciarse
- ET = [E] + [ES]
- [E] ≠ ET
- La velocidad de transformación de sustrato en producto está limitada por K₂
- v₀ = KCAT*[ES]
- Hipótesis del estado estacionario: como la concentración de enzima es muy pequeña y la concentración de sustrato muy grande en el primer momento se llega a una concentración de complejo enzima - sustrato que es constante para toda la reacción
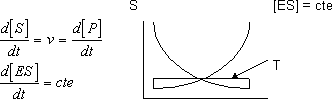
El enzima siempre tiene moléculas de sustrato en su centro activo de manera que la concentración de enzima - sustrato será prácticamente constante por lo que:
- Velocidad de formación = velocidad de descomposición
- K₁·[E]·[ES] = K₋₁·[ES] + KCAT·[ES]
- [ES·(K + KCAT)]

A la relación entre constantes se le denomina constante de Michaelis - Menten:
![]()
En lugar de ponerlo en función de enzima libre lo ponemos en función de complejo enzima - sustrato:
[E] = [ET] - [ES]

KM·[ES] = [E] - [S] - [ES]·[S] ⇒ [ES]·(KM + [S]) = [E] + [S]
v₀ = KCAT·[ES]
![]()
v₀ = considerando que [ES] = [ET] ⇒ KCAT = [ET] = V
Esto es válido para cuando todo la enzima esté formando complejo enzima - sustrato y si la enzima sigue la cinética de Michaelis - Menten.
![]()

- La velocidad crece proporcionalmente a la concentración de sustrato, es de orden 1 respecto al sustrato
• Si la concentración de sustrato es grande, Kₘ es despreciable:
- V = v₀
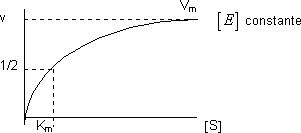
- La velocidad es independiente respecto a la concentración de sustrato. Es lo que ocurre en el tramo final de la gráfica que tiende asintóticamente a V. Es la ecuación de una hipérbola
El enzima presenta saturación de velocidad respecto a la concentración de sustrato. El enzima no seguirá la cinética de Michaelis - Menten si tiene cooperatividad en la unión del sustrato por lo que la curva será sigmoidea. La V será igual y la saturación dependerá e la concentración de enzima. La saturación se alcanza para determinada concentración de enzima, si la concentración de enzima es el doble la velocidad será el doble. La velocidad y υ son dos formas de expresar la actividad de una proteína.
Significado de los parámetros
Kₘ: Relación entre las constantes cinéticas. Caracteriza la interacción de la enzima con su sustrato, aunque no depende de sus concentraciones. El valor fisiológico de Kₘ va desde 10⁻¹ hasta 10⁻⁷ M. Tiene unidades de concentración. Se puede calcular gráficamente su valor:
v₀ = V/2 = V·[S]/(Kₘ + [S]) ⟶ Kₘ = [S]
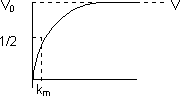
Kₘ tiene el mismo valor que la concentración de sustrato.
Se suele relacionar con otras constantes:
Si KCAT es mucho más pequeña que K₋₁, KCAT es despreciable en el numerador:
Kₘ = K₋₁/K₁ = 1/Kafinidad
Por lo tanto Kₘ es una medida inversa de la afinidad de la enzima por el sustrato. Al aumentar Kₘ, Kafinidad baja.
Kcat: constante catalítica. Es la capacidad de la enzima para llevar a cabo la transformación. Recibe también el nombre de número de recambios, cantidad máxima de moléculas transformadas por unidad de tiempo (sustrato, producto) por molécula de enzima o por número de sitios activos. Siempre en condiciones de saturación de manera que la cantidad de sustrato no sea limitante. Se mide en s⁻¹. El número de recambios se calcula fácilmente:
Kcat = V/[ET]
KCAT/KM: establecer eficacia catalítica de la enzima. En las células para enzimas de Michaelis - Menten la concentración de sustrato es mucho más pequeña que Kₘ, como mucho son iguales. Si la concentración de sustrato es mucho menor la velocidad cambia mucho para intervalos de concentración de sustrato pequeños. Podemos despreciar en el denominador:
v₀ = V·[S]/K = (Kcat/Kₘ)·[E]·[S]
Donde KCAT/KM es la constante de un proceso que depende de las concentraciones de enzima y sustrato (es como si fuera su constante de velocidad). Tiene un límite superior en K₁. Ello significa que la reacción más rápida depende de K₁ y ésta de la unión de enzima y sustrato. Los enzimas con cinética más rápida son los de difusión de enzima - sustrato más alta, que es la rapidez con la que el sustrato llega al sitio activo. Cada vez que un sustrato llega a un sitio se transforma, por lo que la velocidad depende de lo rápido que llega el sustrato al sitio.
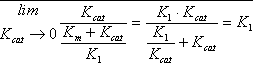
Por ello KCAT = ∞. Para la enzima más rápido la velocidad depende sólo de K₁. Los enzimas con KCAT/km = K₁ son los más rápidos posible y se dice que han alcanzado la perfección cinética.
KCAT/km es el criterio de especificidad (grado de discriminación) que no depende de Kₘ sino de KCAT/km que permite distinguir entre dos sustratos con los que puede actuar.
E + A ∫EA ◊ P VA
E + B ∫EB ◊ P VB
Si la enzima es más específico por A entonces VA > VB, VA/VB > 1 prefiere A. Si se ponen en concentraciones iguales siendo la concentración de enzima constante:
VA = KCATA/KₘA·[E]·[A]
VB = KCATB/KₘB·[E]·[B]
VA/VB = (Kcat A/Kₘ A)/(Kcat B/Kₘ B)
Cálculo gráfico.
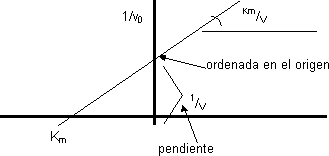
Transformamos la ecuación en la de los dobles inversos con lo que sale la ecuación de una recta, calculando sólo algunos puntos se puede obtener:
1/v₀ = (Kₘ + [S])/(V·[S]) = (Kₘ/V)·(1/[S]) + (1/V)
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).