La química analítica y la electromedicina en la determinación del intervalo postmortem
Introducción:
La estimación de la hora del fallecimiento, cuando éste ha sucedido en ausencia de testigos que hubieran podido cronometrarla, es un dato de singular importancia en la medicina general pero fundamental en criminalística. Esto se puede efectuar mediante varios métodos descritos en la bibliografía Forense.
Esta parte de la medicina legal se llama crono-tanato-diagnóstico y proviene de las palabras griegas cronos = tiempo; tanatos = muerte y diagnóstico = conocimiento. (1)
La palabra tanatología proviene del griego: tanatos: muerte y logos: tratado y es la parte de la medicina legal que estudia las modificaciones del organismo humano a partir del momento mismo de haberse producido la muerte. Entre estos fenómenos fisicoquímicos, biológicos y microbiológicos suelen mencionarse con mayor frecuencia el descenso de la temperatura; el rigor mortis; la lividez cadavérica; la acidez, la autólisis y finalmente la putrefacción. Aunque se han omitido algunos, entre éstos los de mayor importancia para el laboratorista son:
1) La acidez: En una escala de acidez y basicidad llamada escala de pH, comprendida entre 1 y 14, el punto neutro (es decir que no hay ni ácido ni base) es el 7. El cuerpo humano es ligeramente básico (pH 7,3), si bien el pH del estómago es menor debido al ácido clorhídrico contenido en los jugos gástricos.
Tras la muerte, el pH desciende a 7. Pero en el supuesto de no disponer del instrumento idóneo para medir dicha variación, la prueba ha de realizarse con papel tornasol aplicado en el interior del párpado de abajo. Si el color rojizo del papel tornasol se vuelve de color azul, el pH es alcalino, no ácido, y es síntoma de vida en el individuo examinado. Un químico que actúa en terreno, utilizará papeles indicadores de pH (papeles que cambian el color a uno adecuado con la variación del pH y con un rango mucho más ajustado que el del tornasol. Esta prueba debe efectuarse en terreno y lo antes posible.

| Los papeles indicadores son aptos y se comercializan con un estrecho rango de pH |
| La tanatoquimia es una ayuda importante aunque tiene sus limitaciones. Se conocen las alteraciones de los constituyentes bioquímicos en el período postmortem, especialmente en la sangre y los resultados de las investigaciones publicadas, en ocasiones están sujetos a controversia. Por esta razón se ha enfatizado el examen de fluidos que no se alteran o contaminan con tanta rapidez como la sangre después de la muerte. El humor vítreo (HV), el líquido cefalorraquídeo (LCR), el líquido pericárdico (LP) o el líquido sinovial (LS) se han utilizado con estos fines | |
2) La autólisis: (Auto = por sí mismo. Lisis = destrucción). El proceso de autolisis del cadáver se caracteriza por la pérdida de las células tras sobrevenir la anoxia (falta de oxígeno, por lo que es un proceso anaeróbico), la acidez, la desnutrición celular, el descenso de la temperatura, etcétera. Es un fenómeno producido en el citoplasma celular tras la destrucción de la membrana de los lisosomas y posterior liberación de lisozima, que es una enzima, por lo que la autólisis es producida por las propias enzimas del organismo sin intervención de bacterias.
Siempre se deben tener en cuenta las condiciones ambientales que acompañan el cuerpo. Por ejemplo, la autólisis, que es un proceso normal a temperatura ambiente, se acelera en un clima tropical, de la misma forma que ocurre con la putrefacción, mientras que se retrasa en un clima frío. Desde el punto de vista químico, el perito deberá tener en cuenta esas condiciones, registrando la temperatura del ambiente en donde se halló el cuerpo, ya que si fuera de la habitación está nevando, dentro bien puede haber calefacción, o en un clima tropical, afuera una temperatura alta y dentro aire acondicionado. La condición excluyente es que el cuerpo se haya mantenido a temperatura ambiente (entre 20 y 25 °C)
El órgano más frágil a la putrefacción es el cerebro y los más resistentes el corazón, el útero y la próstata. No obstante la membrana que envuelve el globo ocular es muy resistente y el fluido contenido dentro, un gel que mantiene al ojo en su forma, se llama Humor Vítreo (H V) y es la muestra elegida por varios investigadores para la determinación del Potasio que es el principal ion intracelular que aumenta su concentración en el H V al aumentar la autólisis de los glóbulos rojos.
El vítreo es una estructura gel-líquido, que ocupa ⅘ partes del ojo limitada por la retina, cuerpo ciliar y el cristalino. Físicamente es un hidrogel con un peso total de 3,9 g y un volumen aproximado de 3,9 ml y aunque aparentemente es una estructura homogénea, los estudios bioquímicos y biomicroscópicos demuestran que el vítreo es tremendamente complejo. No se halló bibliografía sobre la relación entre la temperatura ambiente y la autólisis en el caso específico del Humor Vítreo, no obstante en la fórmula que se consigna a continuación, no se halla ningún tipo de corrección, por lo que se entiende que éste proceso está desprovisto de la acción de la temperatura (considerando por supuesto a un cuerpo ni congelado ni quemado).
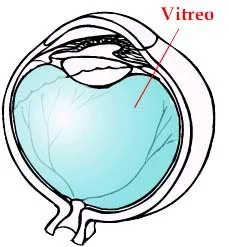
Los datos más fiables se obtienen de marcadores en este último, especialmente el potasio (K), ya que el humor vítreo es un fluido prácticamente aislado de todos los fenómenos putrefactivos y el potasio es el principal ion intracelular, el cual aumenta su concentración al aumentar la tasa de autolisis.
3) La determinación del ion potasio: se recomienda realizar ésta determinación con un electrodo ion selectivo.
El aparato es fundamentalmente un peachímetro con varias funciones, de la que se selecciona la utilización de este tipo de electrodos.
El aparato consiste en un electrodo específico para cada ion, en este caso el potasio, y un amplificador con un conversor analógico/digital que procesa os datos haciéndolo legibles en un display.
La construcción del electrodo es la siguiente:
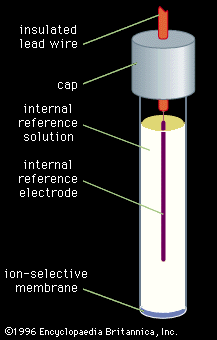 | En donde el cable anaranjado superior es el conductor hacia el amplificador (generalmente un peachímetro) |
Para tener una idea del aspecto físico del equipo se muestra una fotografía:

| Características:Instrumento Multiparametrico con pantalla gráfica. El HI 4.211 es un instrumento de sobremesa con pantalla gráfica, para la medición del pH, mV, iones selectivos y temperatura. El equipo puede ser calibrado fácilmente utilizando hasta 5 puntos de calibración. Los datos de calibración pueden ser retomados en cualquier momento (GLP) y se puede programar para programar una alarma de fecha de vencimiento de la calibración | ||||||||||||
Las mediciones se pueden hacer manualmente o en forma automática y se registran hasta 5.000 muestras. Los datos pueden ser traspasados a PC a través de RS232 y USB. Gracias a la amplia pantalla gráfica, es posible seguir simultáneamente las medidas ejecutadas por ambos canales, además de tener informaciones constantes acerca del estado del electrodo y acerca de la fecha de la última calibración. Los pulsantes superiores del teclado asumen un significado diferente según el tipo de ventana, volviendo aún más simple la interacción entre el usuario y el instrumento. Tabla de Especificaciones
| |||||||||||||
Nótese el rango de precisión de concentración de iones que se extiende desde los 0,001 a 1 ppm.
Este método se llama potenciométrico (genera una diferencia de potencial que luego es medida). Basándose en la selectividad de distintas membranas para dejar pasar determinados iones.
Membranas de electrodos:

| 
|
El componente sensible del electrodo es la membrana. El tipo de membrana varía de acuerdo a la muestra que se desea medir. Las membranas deben ser sólidas y de material inalterable. Por ejemplo para medir soluciones de calcio se usa una de PVC; para Sodio una de vidrio. (4)
Una vez hallada la concentración, se integra a la siguiente fórmula y se obtiene una curva de regresión cuya ecuación es:
intervalo post mortem = 3,38×[K+] - 10,66.
Y que sirve para la presunción del período post mortem.
El H V se extrae del globo ocular con una jeringa de 5 ml. utilizando aguja N° 20 y ubicándola en la parte central del globo ocular (6).
Si el ensayo no se hace en forma inmediata, éste debe congelarse para detener la autólisis y consiguiente aumento de la concentración de Potasio, para descongelarlo posteriormente.
El método referido hasta la fecha es el del electrodo ion selectivo, no obstante se consigna una bibliografía y se desarrollan los conocimientos relacionados con la misma que utiliza un fotómetro de llama (3)
Métodos alternativos: La metodología analítica del potasio se realiza por varios métodos, los más frecuentes son la potenciometría y la fotometría de llama. Según los métodos utilizados puede haber algunas diferencias en los resultados [1] Ferslew propuso el análisis por ion capilar, electroforesis capilar con buena correlación con la potenciometría directa con ion selectivo [2], no obstante, se conoce que no muchos laboratorios disponen de éste elemento. La posibilidad de efectuarla por fotometría de llama es mucho más accesible (3).
4) El rol de la electromedicina: la Electromedicina es una disciplina que amalgama los procesos biológicos con la electrónica.
Luego de la invención del peachímetro, los electrónicos han desarrollado un electrodo que permite el, paso selectivo de un elemento a través de su membrana. Una vez dentro, este elemento produce un voltaje del orden de los milivoltios que se amplifica y mide.
Para la medición de la concentración de Potasio en el H V se sugiere el uso del electrodo ion selectivo, que es un método denominado Potenciométrico (produce diferencia de potencial o voltaje).
El electrodo se calibra con una solución de concentración conocida de potasio, utilizando para ello Cloruro de Potasio Pro Análisis de alta pureza, droga denominada patrón primario, secada y diluida en un agua bidestilada para evitar errores. Luego de la calibración del equipo, el electrodo, se sumerge en la muestra de H V para su medición.
Técnica alternativa y más económica: Muchos laboratorios poseen fotómetros de llama, equipos destinados a la medición de Sodio y Potasio en sangre, algunos incluyen Litio para el dosaje de Li en pacientes con litioterapia (Carbonato de Litio utilizado en tratamientos psiquiátricos).
El Fotómetro de llama es, como su nombre lo indica (photos = luz, metro, medir), es un instrumento capaz de medir la luz emitida por una llama en la que interviene el ion a analizar.
Cada metal (en este caso si está en solución es llamado ion), calentado sobre una llama de mechero en determinadas condiciones, produce un color característico.

Así, un compuesto de Sodio expuesto sobre un hilo de Platino (metal inerte en este caso), sobre una llama, produce un color amarillo - anaranjado; el Potasio produce una coloración violeta como muestra la figura.
Este efecto es utilizado por el fotómetro de llama para determinar la concentración de una solución desconocida, luego de calibrar el aparato con una solución cuya concentración se conoce.
La sensibilidad el fotómetro de llama es muchísimo más baja que la de un electrodo ion selectivo, pero extraordinariamente más accesible y económica.
Sensibilidad Ion selectivo: 0,001 mg/l
Sensibilidad fotómetro de llama: 23 mg/l
El aparato funciona como se describe en el siguiente gráfico:
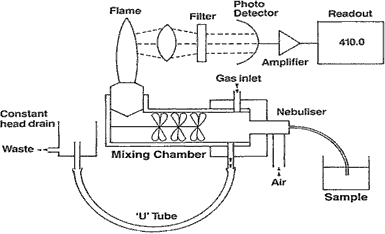
El equipo tiene tres ingresos: 1- el de la energía eléctrica para el funcionamiento de los componentes electrónicos; 2- el de un compresor para lograr el nebulizado de la muestra y 3- el del gas para la combustión.
La muestra (sample) ingresa por un capilar a la cámara de nebulización para luego mezclarse con el gas el que estará en combustión en el mechero. Como se referenció anteriormente, cada ion o metal disuelto (sodio o potasio) conferirá a la llama un color característico y éste deberá atravesar un filtro monocromatizador hasta llegar al fotodetector y posteriormente al instrumento de medición.
En Argentina una marca fue pionera y lideró por muchos años la fabricación de equipos de fotometría de laboratorio, creyendo quien redacta, que fue la primera pues no se tiene conocimiento de otra. El Laboratorio electrónico Crudo Caamaño desarrolló un fotómetro de llama que se comercializó con singular éxito a partir de mediados de los '50 y que hasta el presente es utilizado en muchos laboratorios brindando resultados reproducibles y chequeados por controles de calidad externos.
Se exponen fotos del mismo cerrado y también de su interior para una mayor comprensión del proceso de funcionamiento.

| 
| 
|
| Puede observarse el fotómetro desde afuera y la cámara de nebulización con ingreso de aire comprimido. En la foto del medio se observa el recipiente donde se aloja la muestra. En la tercer foto se puede observar el compresor. El equipo posee un miliamperímetro dividido en 100 unidades que permiten la lectura de la concentración de Potasio/Sodio | ||
Los fotómetros de llama han tenido modificaciones principalmente para una mayor comodidad del operador. Luego de la aparición del Crudo Caamaño, la empresa Metrolab diseñó varios modelos desde analógicos (ya con fotodetector a fotodiodo y amplificador con un circuito integrado) hasta los modernos digitales, no obstante el procedimiento es el mismo descrito anteriormente. (5)

| 
|
| Metrolab analógico | Metrolab digital |
Bibliografía:
- Métodos químicos para el cálculo de la data de la muerte. En Casas J, Rodríguez S. Medicina Legal. Ed Colex. Madrid 2.000: 1.125
- Ferslew K, Hagardon A, Harrison M, Mc Cornuck W. Capìllary ion analisis of potassiun concentrations in human vitreous. Electrophoresis 1.988; 19: 6-10.))
- Trezza propone el método de fotometría de llama:
Titre du document/Document title: Investigación del intervalo post-mortem I: Análisis de la concentración de potasio en humor vítreo mediante fotometría de llama (Determination of vitreous potassium concentration by flame photometry as an indicator of the post-mortem interval)
Auteur(s)/ Author(s) Trezza, Fernando C.; Costa, Roberto A.;
Résumé/Abstract: The aim of the present study was to evaluate the human postmortem interval estimation using the vitreous potassium concentration by flame photometry. We conclude that the use of potassium concentration for the prediction of the post-mortem interval, is an effective method of estimating the time since death. The methodology employed by the authors to study the post-mortem chemistries on human vitreous humor in forensic pathology is described in the article.
Revue/Journal Title Prensa médica argentina (Prensa méd. argent.) ISSN 0032-745X CODEN PMARAU
2.002, vol. 89, no9, pp. 813-824 [12 page(s) (article)]
Langue/Language Espagnol
Editeur/Publisher Prensa médica argentina, Buenos Aires, Argentine (1.914) (Revue) - Pagina oficial de Radiometer Analytical
- Página oficial de Metrolab
- Validación e implementación del método ion selectivo para el análisis de electrolitos, y el de colorimetría para análisis de urea y creatinina, en Humor Vítreo de Cadáveres - Olga L. Sopó, Bacterióloga, Pontificia Universidad Javeriana. Revista del INML y CF. Vol 17 No 1. 2.002; 28-3
* Las fotografías de la pagina 7 pertenecen a equipos reparados en el servicio Electromedicina & Servicios.
Técnico Superior en Electromedicina - Químico. Analista químico en general y de aguas en particular desde 1.977.
Email: ricardobotta@hotmail.com - Para información de servicios puede ingresar al sitio: www.rickybotta.blogspot.com.
Autor: Ricardo Botta. Técnico Superior en Electromedicina. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).