Ecuación de Arrhenius (segunda parte)
Catálisis homogénea
Aunque no siempre existe una proporcionalidad simple las reacciones con catalizadores sólidos, en las catálisis homogéneas por lo general prevalece una proporcionalidad directa entre la velocidad y la concentración del catalizador. Por ejemplo la hidrólisis de éster es una solución ácida dependerá del ion hidrógeno que actúa como catalizador.
La presencia de un catalizador no cambia la posición de equilibrio en una reacción reversible. Esta conclusión se ha comprobado en forma experimental varias veces. Por ejemplo, la oxidación del bióxido de azufre con oxígeno ha sido estudiada con tres catalizadores: platino, óxido férrico y pentóxido de vanadio. En los tres casos, las composiciones de equilibrio resultaron iguales.
Una de las características importantes de un catalizador es su efecto sobre la selectividad cuando puede verificarse varias reacciones. Una buena ilustración es la descomposición del éter. La descomposición térmica produce agua, etileno e hidrógeno. Sin embargo, si el vapor de etanol se pone en contacto con partículas de alúmina, los únicos productos son etileno y agua. En contraste, cuando el etano reacciona sobre un catalizador de cobre, el único producto que se obtiene es el acetaldehído.
Las características generales de los catalizadores pueden resumirse como sigue:
1) Un catalizador acelera la reacción al proporcionar otros posibles mecanismos para la formación de productos, siendo la energía de activación de cada etapa catalítica, inferior a la de la reacción homogénea (no catalítica)
2) En el ciclo de la reacción, los centros de catálisis activos se combinan con cuando menos un reactante y quedan libres al aparecer el producto. El centro liberado se puede recombinar con otro reactante para producir otro ciclo, así sucesivamente
3) Se requieren cantidades de centro catalíticos comparativamente pequeñas para formar grandes cantidades del producto
4) La conversión de equilibrio no es alterada por la catálisis. Cualquier catalizador que acelere la reacción directa en un sistema de equilibrio también cataliza la reacción inversa
5) El catalizador puede afectar radicalmente a la selectividad
Catálisis heterogénea
La comprensión del mecanismo de funcionamiento de los catalizadores ha sido un problema muy desafiante y elusivo. La aceptación que han llegado a tener varias teorías desaparece como explicación general de la actividad catalítica a medida que se van obteniendo nuevas evidencias experimentales. En orden cronológico, Sebatier sugirió que el mecanismo de la actividad del níquel como catalizador de hidrogenación, puede involucrar la formación de un compuesto químico; el hidruro de níquel.
De acuerdo con este concepto, la actividad catalítica de una superficie sólida depende de la separación entre los átomos, lo que facilita la adsorción de las moléculas reactantes. Con el paso del tiempo, han surgido muchas dudas sobre la teoría geométrica, excepto en lo que se refiere a las películas metálicas.
Los catalizadores incluyen sustancias de tipo muy común como gel de sílice, alúmina y sus combinaciones. Aun a temperaturas elevadas, se supone que los electrones no pueden moverse a través de sólidos con la suficiente libertad como para que puedan actuar como conductores. Estas sustancias son también ácidos fuertes. Su actividad en las muchas reacciones de hidrocarburos que catalizan, se debe probablemente a la formación de iones carbonio en los centros ácidos de la superficie. Aunque se han publicado muchos artículos sobre los mecanismos de los iones carbonio, el trabajo original de muchos artículos sobre los mecanismos de los iones carbonio, el trabajo original de Witmore y la posterior investigación.
Para comprender cabalmente el comportamiento de los catalizadores sólidos es necesario conocer la estructura química de la especie adscriba. Hasta ahora, esto constituye un problema sin solución excepto en unos cuantos casos. Sin embargo algunos adelantos recientes en el desarrollo y mejora de diversas técnicas espectroscópicas para el análisis de las propiedades superficiales y globales de los sólidos, han hecho concebir grandes esperanzas. Estas técnicas incluyen dispersión de rayos X, resonancia magnética nuclear.
Determinación del área superficial de los catalizadores, BET (Brunauer-Emmett-Teller)
El método más común para la medición de áreas superficiales se basa en la adsorción física de un gas en la superficie sólida. Generalmente se determina la cantidad de nitrógeno gaseoso adsorbido en equilibrio al punto de ebullición normal (-195,8 °C) en un intervalo de presiones inferior a 1 atmósfera. Bajo estas condiciones, se pueden adsorber consecutivamente varias capas de moléculas sobre la superficie. Bajo estas condiciones, se pueden adsorber consecutivamente varias capas moleculares sobre la superficie. Para poder determinar el área es necesario identificar la cantidad adsorbida que corresponde a una capa monomolecular. Emmett ha explicado claramente las etapas históricas del desarrollo del método Brunauer-Emmett-Teller. Puede existir una incertidumbre con relación a si los valores obtenidos con el método corresponde con exactitud al área superficial. Sin embargo, esto tiene poca importancia relativa, pues el proceso está normalizado y los resultados son reproducibles. Cabe mencionar que el área superficial medida de esta manera puede no ser la efectiva para la catálisis. Por ejemplo, solo algunas partes de la superficie, esto es, los centros activos, pueden ser efectivos para una quimisorción de un reactante, mientras que el nitrógeno puede ser físicamente adsorbido en una extensión superficial mucho mayor. Además cuando el catalizador está dispersado en un portador de área considerable, es posible que solo una parte del área del portador esté recubierta con átomos catalíticamente activos y esta área puede ser de varios átomos de profundidad. Por tanto, los átomos activos pueden estar juntos en grupos de modo que la superficie catalítica sea menor que si los átomos estuvieran más completamente dispersos o separados. Por ejemplo, se encontró que un catalizador de níquel sobre Kieselgur tiene una superficie de 205 m² /g, medida por adsorción del nitrógeno. Para determinar el área recubierta por átomos de níquel, se quimisorbio, se calculó que el área superficial de átomos de níquel es de unos 40 m² /g. Seria muy útil conocer las áreas superficiales para quimisorción del reactante en las condiciones de la reacción. Sin embargo requeriría la medición de cantidades de quimisorción relativamente pequeñas, a diferentes y a veces difíciles condiciones (alta presión y/o temperatura), para cada sistema reaccionante. En contraste, el nitrógeno puede adsorberse fácil y de manera rápida en forma rutinaria con equipo normal.
En el método clásico para determinar áreas superficiales se usa un aparato en su totalidad construido de vidrio para medir el volumen del gas adsorbido en una muestra del material sólido. El aparato opera a presiones bajas que pueden variarse desde casi cero hasta una atmósfera. La temperatura de operación es del orden de magnitud del punto de ebullición normal. Los datos obtenidos son volúmenes observados se corrigen a centímetros cúbicos.
A 0 °C y 1 atmósfera (temperatura y presión normales) y se grafican en función de la presión en milímetros, o en forma de la relación entre la presión y la presión de Vapor a la temperatura de operación.
Volumen adsorbido, cm³ (760 mm, 8 C°)
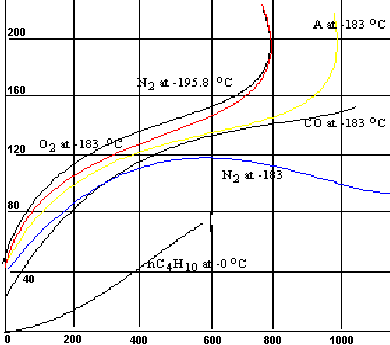
Presión, mm
En esta figura se muestran los resultados típicos del trabajo de Brunauer y Emmett para la adsorción de diversos gases en una muestra de 0,606 g de sílice. Para simplificar el procedimiento experimentalmente clásico, se ha desarrollado un método de flujo en el cual se hace pasar continuamente sobre la muestra del sólido, una mezcla de helio (u otro gas no adsorbido) y del gas adsorbible. La presión total de operación es constante y la presión parcial del gas se hace variar cambiando la posición de la mezcla.
Las curvas de la figura anterior son similares en cuanto a que bajas presiones aumentan más o menos rápido, aplanándose en una sección lineal a presiones intermedias y, por último, aumentan su pendiente a mayores niveles de presión.
El método de Brunauer-Emmett-Teller localiza este punto a partir de una ecuación obtenida extendiendo la isoterma de Langmuir para aplicarla a una adsorción de capas múltiples. El desarrollo se puede resumir en la siguiente forma:
p/v = 1/K·vₘ + p/vₘ. (1)
Brunauer, Emmet y Teller adaptaron esta ecuación para adsorción en capas múltiples y llegaron al resultado.
p/v·(p₀ - p) = 1/vₘ·c + (c - 1)·p/c·vₘ·p₀. (2)
Donde p₀ es la presión de vapor o de saturación y c es una constante para cada temperatura y cada sistema gas-sólido.
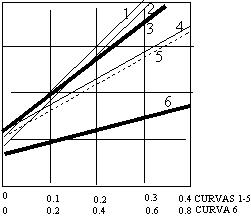
p/v·(p₀ - p)·10³
p/p₀ | Curva: |
|
1) CO₂ a -78 °C 2) A a -183 °C 3) N₂ a -183 °C 4) O₂ a -183 °C 5) CO₂ a -183 °C 6) nC₄ H₁₀ a -195,8 °C |
Gráfica de la ecuación (2) de Brunauer-Emett-Teller para los datos anteriores.
De acuerdo con la ecuación (2) una gráfica de p/v·(p₀ - p) en función de p/p₀ debe dar una línea recta. En la figura anterior se vuelven a graficar de esta forma los datos de la figura 1. Resulta muy significativo que dichas líneas rectas pueden extrapolarse con seguridad hasta p/p₀ = 0. La intercepción I obtenida con esta extrapolación, junto con la pendiente de la línea recta, s, proporciona dos ecuaciones de las cuales puede obtenerse Vₘ.
I = 1/Vₘ·c a p/p₀ = 0
s = c - 1/Vₘ·c
Resolviéndolas para el volumen de gas correspondiente a la capa monomolecular, se obtiene.
Vₘ = 1/1 + s
El volumen Vₘ puede convertirse fácilmente al número de moléculas adsorbidas. Sin embargo, para determinar el área absoluta es necesario seleccionar un valor para el área cubierta por una molécula adsorbida. Si esta área por molécula es α, el área de superficie total está dada por la relación
Sg = [Vₘ·Nₒ/V]·α
Donde Nₒ es el número de Avogadro 6,02·10²³ moléculas/mol, y V es el volumen por mol de gas a las condiciones de Vₘ. Puesto que Vₘ se registra a temperaturas y presión normales, V = 22.400 cm³/mol·g.
Adsorción en sólidos
Ecuación de Freundlich
La isoterma de Freundlich fue una de las primeras ecuaciones propuestas para relacionar la cantidad adsorbida con la concentración del material en la solución:
m = k·c1/n
Donde m es el número de gramos adsorbidos por gramo de adsorbente, c es la concentración, y k y n son constantes. Midiendo m como función de c y representando gráficamente log₁₀ m contra log₁₀ c, es posible hallar los valores de n y k a partir de la pendiente y la intersección de la línea. La isoterma de Freundlich si es muy alta la concentración (o presión) del adsorbato.
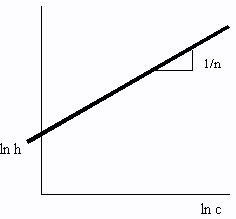
ln m = ln h + 1/n ln c
Ecuación de Langmuir
Podemos representar el proceso de adsorción por medio de una ecuación química. Si el adsorbato es un gas podemos escribir el equilibrio.
A(s) + S ⇌ AS
Donde A es el adsorbato gaseoso, S es un sitio desocupado sobre la superficie y AS representa una molécula de A adsorbida o un sitio desocupado sobre la superficie.
La constante de equilibrio puede expresarse
K = xₐₛ/xₛₚ
Donde xₐₛ es la fracción molar de sitios ocupados en la superficie, xₛ es la fracción molar de sitios libres en la superficie y p es la presión del gas. Es más común usar θ por xₐₛ, entonces xₛ = (1 - θ) y la ecuación puede escribirse.
θ/1 - θ = Kp
Que es isoterma de Langmuir; K es la constante de equilibrio para la adsorción. Resolviendo para θ, obtenemos
θ = Kp/1 + Kp
Si hablamos de la adsorción de una sustancia de la solución, la ecuación es válida si se sustituye p por la concentración molar c.
La cantidad de sustancia adsorbida, m, será proporcional a θ para un adsorbente específico, de manera que m = b θ, donde b es una constante. Entonces
m = b·Kp/1 + Kp,
1/m = 1/b + 1/b·Kp
Representando gráficamente 1/m contra 1/p, se pueden determinar las constantes K y b a partir de la pendiente y la intersección de la línea. Conociendo K, podemos calcular la gráfica de superficie cubierta.
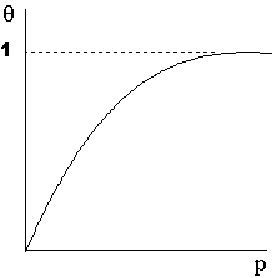
Isoterma de Langmuir
Bibliografía:
- Cinética de reacciones, Keith J. Laidler, Editorial Alhambra, Méxco D.F. 1979.
- Ingenieria de la Cinética Química, M. Smith, Editorial Continental, Méxco 1990.
- Fisícoquimica, Castellan W., Editorial M.H, Méxco 1991.
Autor: Cesar Arizmendi.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›