Entalpía y calor de formación
Se denomina calor de formación de un compuesto, a la variación de entalpía cuando se forma un mol de ese compuesto a partir de sus elementos.
En la reacción entre el carbono y el oxígeno:
C + O₂ ⟶ CO₂
ΔH = -94,3 kcal
El calor de formación es negativo, pues la reacción desprende calor.
La entalpía de los elementos se considera (aunque ello no es exacto) que vale cero.
De acuerdo con esta convención, la entalpía de un compuesto es igual a su calor de formación.
Aplicando estas dos conclusiones se puede calcular el intercambio de calor en una reacción química. Ver tablas de entalpías de formación I a IX.
Por ejemplo:
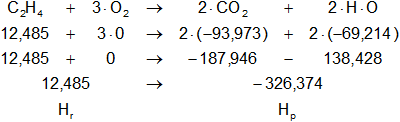
El intercambio de calor de la reacción es:
ΔH = Hₚ - Hᵣ
ΔH = -326,374 kcal/mol + 12,485 kcal/mol
ΔH = -313,889 kcal/mol
O sea, que en esta reacción de combustión se desprenden 313,889 kcal.
Calor de formación y estabilidad
Observando la tabla de calores de formación, se obtiene el calor de formación del cloruro de calcio -190,000 kcal/mol y el del carbonato de calcio -288,232 kcal/mol.
Si se desea descomponer en sus elementos al cloruro de calcio, habrá que suministrar 190,000 kcal/mol y, si se quiere hacer lo mismo con el carbonato de calcio habrá que suministrar 288,232 kcal/mol. Esto indica que es más estable el carbonato de calcio que el cloruro de calcio.
El calor de formación nos indica la estabilidad de un compuesto.
Cuanto menor sea el calor de formación de un compuesto mayor será su estabilidad.
Para seguir el hilo del concepto:
Reacción exotérmica: ΔH < 0 ⟶ Producto de reacción más estable.
Reacción endotérmica: ΔH > 0 ⟶ Producto de reacción menos estable.
Ejemplo nº 1:
Dada la reacción:
CaCO₃ ⟶ CaO + CO₂
Indicar:
a) Si la reacción es endotérmica.
b) Calcular, consultando la tabla, la cantidad de kcal que se intercambian con el medio ambiente al descomponerse 3 moles de CaCO₃.
Solución:
a) Se busca en la tabla de entalpías de formación la entalpía de cada sustancia:
ΔH: CaCO₃ = -288,232 kcal/mol
ΔH: CaO = -152,000 kcal/mol
ΔH: CO₂ = -93,973 kcal/mol
Luego:
ΔH = Hₚ - Hᵣ
ΔH = -152,000 kcal/mol -93,973 kcal/mol - (-288,232 kcal/mol)
ΔH = -152,000 kcal/mol -93,973 kcal/mol - (-288,232 kcal/mol)
ΔH = -245,973 kcal/mol + 288,232 kcal/mol
ΔH = 42,259 kcal/mol
ΔH = 42,259 kcal/mol > 0 ⇒ endotérmica
Esto significa que para descomponer el CaCO₃ hay que calentar el compuesto.
b) La cantidad de calorías que se necesitan para descomponer 3 moles de CaCO₃ será:
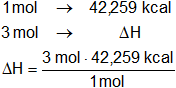
ΔH = 126,777 kcal
Calor de combustión
El calor de combustión es la cantidad de calor que acompaña a la combustión completa de un mol de una sustancia. En este tema trataremos la combustión que se realiza con oxígeno puro.
| Sustancia | ΔH |
|---|---|
| Metano (g) | -212,8 |
| Etano (g) | -373,0 |
| Acetileno (g) | -310,5 |
| Metanol (l) | -173,7 |
| Etanol (l) | -327,0 |
| Benceno (l) | -783,4 |
| Nafteno (s) | -1.231,0 |
Los calores de combustión son útiles en el metabolismo de grasas, proteínas e hidratos de carbono.
Se puede calcular el calor de la reacción o formación de un compuesto a partir de su calor de combustión.
Ejemplo nº 2:
El calor de combustión del metanol es -173,7 kcal/mol.
Calcular su calor de reacción conociendo los calores de formación de los productos que resultan de su combustión.
Solución:
Ecuación de combustión del metanol:
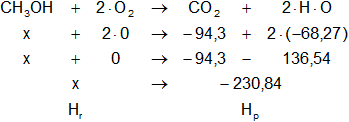
Si ΔH = -173,7 kcal/mol
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos:
-173,7 kcal/mol = -230,84 kcal/mol - x
x = -230,84 kcal/mol + 173,7 kcal/mol
x = 57,14 kcal/mol
Luego la ecuación calórica de formación del metanol a partir de sus elementos es:
C + 2·H₂ + ½·O₂ ⟶ CH₃OH
ΔH = 57,14 kcal/mol
La reacción es exotérmica.
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
Calor de formación y calor de combustión