Problema nº 1 de compuestos químicos, formación de los óxidos, hidróxidos y ácidos. Fórmula desarrollada - TP07
Enunciado del ejercicio nº 1
Dados los siguientes elementos: Fe, K, Mn, Pb, Ba, Be, Br, Ag, Hg, Ni, Ga y Pt;
a) Clasificarlos en metales, no metales y anfóteros.
b) La ecuación química correspondiente a la formación de los óxidos, hidróxidos y ácidos.
c) Nombrar los compuestos obtenidos.
d) Dibujar la fórmula desarrollada.
Solución
a)
Clasificarlos en metales, no metales y anfóteros.
Fe: metal
K: metal
Mn: anfótero
Pb: metal
Ba: metal
Be: metal
Br: no metal
Ag: metal
Hg: metal
Ni: metal
Ga: metal
Pt: metal
b) La ecuación química correspondiente a la formación de los óxidos, hidróxidos y ácidos.
Hierro
Valencia II.
Ecuación de formación de óxido:
2·Fe + O₂ ⟶ 2·FeO (óxido ferroso)
Fórmula desarrollada:
Fe = O
Ecuación de formación del hidróxido:
FeO + H₂O ⟶ Fe(OH)₂ (hidróxido ferroso)
Fórmula desarrollada:
HO - Fe - OH
Valencia III.
Ecuación de formación de óxido:
4·Fe + 3·O₂ ⟶ 2·Fe₂O₃ (óxido férrico)
Fórmula desarrollada:

Ecuación de formación del hidróxido:
Fe₂O₃ + 3·H₂O ⟶ 2·Fe(OH)₃ (hidróxido férrico)
Fórmula desarrollada:
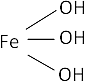
Potasio
Valencia I.
Ecuación de formación de óxido:
4·K + O₂ ⟶ 2·K₂O (óxido de potasio)
Fórmula desarrollada:
K - O - K
Ecuación de formación del hidróxido:
K₂O + H₂O ⟶ 2·KOH (hidróxido de potasio)
Fórmula desarrollada:
K - OH
Manganeso
Valencia II (metal).
Ecuación de formación de óxido:
2·Mn + O₂ ⟶ 2·MnO (óxido manganoso)
Fórmula desarrollada:
Mn = O
Ecuación de formación del hidróxido:
MnO + H₂O ⟶ Mn(OH)₂ (hidróxido manganoso)
Fórmula desarrollada:
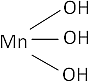
HO - Mn - OH
Valencia III (metal).
Ecuación de formación de óxido:
4·Mn + 3·O₂ ⟶ 2·Mn₂O₃ (óxido mangánico)
Fórmula desarrollada:

Ecuación de formación del hidróxido:
Mn₂O₃ + 3·H₂O ⟶ 2·Mn(OH)₃ (hidróxido mangánico)
Fórmula desarrollada:
Valencia IV (no metal).
Ecuación de formación del anhídrido:
Mn + O₂ ⟶ MnO₂ (anhídrido manganoso)
Fórmula desarrollada:
O = Mn = O
Ecuación de formación del ácido:
MnO₂ + H₂O ⟶ H₂MnO₃ (ácido manganoso)
Fórmula desarrollada:
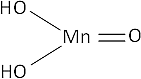
Valencia VI (no metal).
Ecuación de formación del anhídrido:
2·Mn + 3·O₂ ⟶ 2·MnO₃ (anhídrido mangánico)
Fórmula desarrollada:
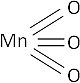
Ecuación de formación del ácido:
MnO₃ + H₂O ⟶ H₂MnO₄ (ácido mangánico)
Fórmula desarrollada:
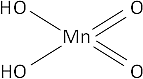
Valencia VII (no metal).
Ecuación de formación del anhídrido:
4·Mn + 7·O₂ ⟶ 2·Mn₂O₇ (anhídrido permangánico)
Fórmula desarrollada:
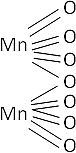
Ecuación de formación del ácido:
Mn₂O₇ + H₂O ⟶ 2·HMnO₄ (ácido permangánico)
Fórmula desarrollada:
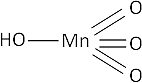
Plomo
Valencia II.
Ecuación de formación de óxido:
2·Pb + O₂ ⟶ 2·PbO (óxido plumboso)
Fórmula desarrollada:
Pb = O
Ecuación de formación del hidróxido:
PbO + H₂O ⟶ Pb(OH)₂ (hidróxido plumboso)
Fórmula desarrollada:
HO - Pb - OH
Valencia IV.
Ecuación de formación de óxido:
Pb + O₂ ⟶ PbO₂ (óxido plúmbico)
Ecuación de formación del hidróxido:
PbO₂ + 2·H₂O ⟶ Pb(OH)₄ (hidróxido plúmbico)
Fórmula desarrollada:
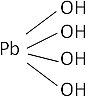
Bario
Valencia II.
Ecuación de formación del óxido:
2·Ba + O₂ ⟶ 2·BaO (óxido de bario)
Fórmula desarrollada:
Ba = O
Ecuación de formación del hidróxido:
BaO + H₂O ⟶ Ba(OH)₂ (hidróxido de bario)
Fórmula desarrollada:
HO - Ba - OH
Berilio
Valencia II.
Ecuación de formación del óxido:
2·Be + O₂ ⟶ 2·BeO (óxido de berilio)
Fórmula desarrollada:
Be = O
Ecuación de formación del hidróxido:
BeO + H₂O ⟶ Be(OH)₂ (hidróxido de berilio)
Fórmula desarrollada:
HO - Be - OH
Bromo
Valencia I.
Ecuación de formación del anhídrido:
2·Br₂ + O₂ ⟶ 2·Br₂O (óxido hipobromoso)
Fórmula desarrollada:
Br - O - Br
Ecuación de formación del ácido:
Br₂O + H₂O ⟶ 2·HBrO (ácido hipobromoso)
Fórmula desarrollada:
H - O - Br
Valencia III.
Ecuación de formación del anhídrido:
2·Br₂ + 3·O₂ ⟶ 2·Br₂O₃ (óxido bromoso)
Fórmula desarrollada:
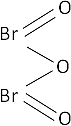
Ecuación de formación del ácido:
Br₂O₃ + H₂O ⟶ 2·HBrO₂ (ácido bromoso)
Fórmula desarrollada:
H - O - Br = O
Valencia V.
Ecuación de formación del anhídrido:
2·Br₂ + 5·O₂ ⟶ 2·Br₂O₅ (óxido brómico)
Fórmula desarrollada:

Ecuación de formación del ácido:
Br₂O₅ + H₂O ⟶ 2·HBrO₃ (ácido brómico)
Fórmula desarrollada:
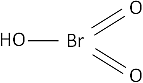
Valencia VII.
Ecuación de formación del anhídrido:
2·Br₂ + 7·O₂ ⟶ 2·Br₂O₇ (óxido perbrómico)
Fórmula desarrollada:

Ecuación de formación del ácido:
Br₂O₇ + H₂O ⟶ 2·HBrO₄ (ácido perbrómico)
Fórmula desarrollada:
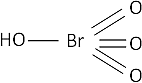
Plata
Valencia I.
Ecuación de formación del óxido:
4·Ag + O₂ ⟶ 2·Ag₂O (óxido de plata)
Fórmula desarrollada:
Ag - O - Ag
Ecuación de formación del hidróxido:
Ag₂O + H₂O ⟶ 2·AgOH (hidróxido de plata)
Fórmula desarrollada:
Ag - OH
Mercurio
Valencia I.
Ecuación de formación del óxido:
4·Hg + O₂ ⟶ 2·Hg₂O (óxido mercurioso)
Fórmula desarrollada:
Hg - O - Hg
Ecuación de formación del hidróxido:
Hg₂O + H₂O ⟶ 2·HgOH (hidróxido mercurioso)
Fórmula desarrollada:
Hg - OH
Valencia II.
Ecuación de formación del óxido:
2·Hg + O₂ ⟶ 2·HgO (óxido mercúrico)
Fórmula desarrollada:
Hg = O
Ecuación de formación del hidróxido:
HgO + H₂O ⟶ Hg(OH)₂ (hidróxido mercúrico)
Fórmula desarrollada:
HO - Hg - OH
Níquel
Valencia II.
Ecuación de formación del óxido:
2·Ni + O₂ ⟶ 2·NiO (óxido niqueloso)
Fórmula desarrollada:
Ni = O
Ecuación de formación del hidróxido:
NiO + H₂O ⟶ Ni(OH)₂ (hidróxido niqueloso)
Fórmula desarrollada:
HO - Ni - OH
Valencia III.
Ecuación de formación del óxido:
4·Ni + 3·O₂ ⟶ 2·Ni₂O₃ (óxido niquélico)
Fórmula desarrollada:
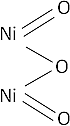
Ecuación de formación del hidróxido:
Ni₂O₃ + 3·H₂O ⟶ 2·Ni(OH)₃ (hidróxido niquélico)
Fórmula desarrollada:

Galio
Valencia III.
Ecuación de formación del óxido:
4·Ga + 3·O₂ ⟶ 2·Ga₂O₃ (óxido de galio)
Fórmula desarrollada:
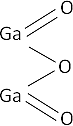
Ecuación de formación del hidróxido:
Ga₂O₃ + 3·H₂O ⟶ 2·Ga(OH)₃ (hidróxido de galio)
Fórmula desarrollada:

Platino
Valencia II.
Ecuación de formación del óxido:
2·Pt + O₂ ⟶ 2·PtO (óxido platinoso)
Fórmula desarrollada:
Pt = O
Ecuación de formación del hidróxido:
PtO + H₂O ⟶ 2·Pt(OH)₂ (hidróxido platinoso)
Fórmula desarrollada:
HO - Pt - OH
Valencia IV.
Ecuación de formación del óxido:
Pt + O₂ ⟶ PtO₂ (óxido platínico)
Fórmula desarrollada:
O = Pt = O
Ecuación de formación del hidróxido:
PtO₂ + 2·H₂O ⟶ Pt(OH)₄ (hidróxido platínico)
Fórmula desarrollada:
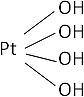
c)
Nombrar los compuestos obtenidos.
Los nombres de los compuestos se dan en el ítem (b).
d)
Dibujar la fórmula desarrollada.
Las fórmulas desarrolladas se dan en el ítem (b).
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, formación de los óxidos, hidróxidos y ácidos. Fórmula desarrollada