Corrosión y protección anticorrosiva
Introducción
El presente trabajo tiene como finalidad ampliar los conocimientos teóricos que se imparten en la cátedra, mediante la investigación bibliográfica de este tema.
Se pretende con ello enfocar varios puntos de vistas sobre un tema que es suma importancia dentro de la carrera de mantenimiento, en vista de los efectos indeseables que la corrosión deja en equipos, maquinarias y estructuras.
Se plantearán las posibles soluciones a este fenómeno natural de los materiales como lo son entre otros y muy principalmente la protección catódica, en sus diferentes versiones.
El trabajo consta de un desarrollo el cual como fue indicado ha sido redactado mediante la investigación en textos.
Definiciones
Se entiende por corrosión a la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. Las características fundamental de este fenómeno, es que sólo ocurre en presencia de un electrólito, ocasionando regiones plenamente identificadas, llamadas estas anódicas y catódicas: una reacción de oxidación es una reacción anódica, en la cual los electrones son liberados dirigiéndose a otras regiones catódicas. En la región anódica se producirá la disolución del metal (corrosión) y, consecuentemente en la región catódica la inmunidad del metal.
Los enlaces metálicos tienden a convertirse en enlaces iónicos, los favorece que el material puede en cierto momento transferir y recibir electrones, creando zonas catódicas y zonas anódicas en su estructura. La velocidad a que un material se corroe es lenta y contínua todo dependiendo del ambiente donde se encuentre, a medida que pasa el tiempo se va creando una capa fina de material en la superficie, que van formándose inicialmente como manchas hasta que llegan a aparecer imperfecciones en la superficie del metal.
Este mecanismo que es analizado desde un punto de vista termodinámico electroquímico, indica que el metal tiende a retornar al estado primitivo o de mínima energía, siendo la corrosión, por lo tanto, la causante de grandes perjuicios económicos en instalaciones enterradas. Por esta razón, es necesario la oportuna utilización de la técnica de protección catódica.
Se designa químicamente corrosión por suelos, a los procesos de degradación que son observados en estructuras enterradas. La intensidad dependerá de varios factores tales como el contenido de humedad, composición química, pH del suelo, etc. En la práctica suele utilizarse comúnmente el valor de la resistividad eléctrica del suelo como índice de su agresividad; por ejemplo un terreno muy agresivo, caracterizado por presencia de iones tales como cloruros, tendrán resistividades bajas, por la alta facilidad de transportación iónica.
La protección catódica es un método electroquímico cada vez más utilizado hoy en día, el cual aprovecha el mismo principio electroquímico de la corrosión, transportando un gran cátodo a una estructura metálica, ya sea que se encuentre enterrada o sumergida. Para este fin será necesario la utilización de fuentes de energía externa mediante el empleo de ánodos galvánicos, que difunden la corriente suministrada por un transformador-rectificador de corriente.
El mecanismo, consecuentemente implicará una migración de electrones hacia el metal a proteger, los mismos que viajarán desde ánodos externos que estarán ubicados en sitios plenamente identificados, cumpliendo así su función
A está protección se debe agregar la ofrecida por los revestimientos, como por ejemplo las pinturas, casi la totalidad de los revestimientos utilizados en instalaciones enterradas, aéreas o sumergidas, son pinturas industriales de origen orgánico, pues el diseño mediante ánodo galvánico requiere del cálculo de algunos parámetros, que son importantes para proteger estos materiales, como son: La corriente eléctrica de protección necesaria, la resistividad eléctrica del medio electrólito, la densidad de corriente, el número de ánodos y la resistencia eléctrica que finalmente ejercen influencia en los resultados.
Tipos de Corrosión
Se clasifican de acuerdo a la apariencia del metal corroído, dentro de las más comunes están:
1) Corrosión uniforme: Donde la corrosión química o electroquímica actúa uniformemente sobre toda la superficie del metal
2) Corrosión galvánica: ocurre cuando metales diferentes se encuentran en contacto, ambos metales poseen potenciales eléctricos diferentes lo cual favorece la aparición de un metal como ánodo y otro como cátodo, a mayor diferencia de potencial el material con más áctivo será el ánodo
3) Corrosión por picaduras: aquí se producen hoyos o agujeros por agentes químicos
4) Corrosión intergranular: es la que se encuentra localizada en los límites de grano, esto origina pérdidas en la resistencia que desintegran los bordes de los granos
5) Corrosión por esfuerzo: se refiere a las tensiones internas luego de una deformación en frío
Protección contra la corrosión
Dentro de las medidas utilizadas industrialmente para combatir la corrosión están las siguientes:
1) Uso de materiales de gran pureza
2) Presencia de elementos de adición en aleaciones, ejemplo aceros inoxidables
3) Tratamientos térmicos especiales para homogeneizar soluciones sólidas, como el alivio de tensiones
4) Inhibidores que se adicionan a soluciones corrosivas para disminuir sus efectos, ejemplo los anticongelantes usados en radiadores de los automóviles
5) Recubrimiento superficial: pinturas, capas de óxido, recubrimientos metálicos
6) Protección catódica
Protección catódica
La protección catódica es una técnica de control de la corrosión, que está siendo aplicada cada día con mayor éxito en el mundo entero, en que cada día se hacen necesarias nuevas instalaciones de ductos para transportar petróleo, productos terminados, agua; así como para tanques de almacenamientos, cables eléctricos y telefónicos enterrados y otras instalaciones importantes.
En la práctica se puede aplicar protección catódica en metales como acero, cobre, plomo, latón, y aluminio, contra la corrosión en todos los suelos y, en casi todos los medios acuosos. De igual manera, se puede eliminar el agrietamiento por corrosión bajo tensiones por corrosión, corrosión intergranular, picaduras o tanques generalizados.
Como condición fundamental las estructuras componentes del objeto a proteger y del elemento de sacrificio o ayuda, deben mantenerse en contacto eléctrico e inmerso en un electrolito.
Aproximadamente la protección catódica presenta sus primeros avances, en el año 1.824, en que Humphrey Davy, recomienda la protección del cobre de las embarcaciones, uniéndolo con hierro o cinc; habiéndose obtenido una apreciable reducción del ataque al cobre, a pesar de que se presento el problema de ensuciamiento por la proliferación de organismos marinos, habiéndose rechazado el sistema por problemas de navegación.
En 1.850 y después de un largo período de estancamiento la marina Canadiense mediante un empleo adecuado de pinturas con antiorganismos y anticorrosivos demostró que era factible la protección catódica de embarcaciones con mucha economía en los costos y en el mantenimiento.
Fundamento de la protección catódica
Luego de analizadas algunas condiciones especialmente desde el punto de vista electroquímico dando como resultado la realidad física de la corrosión, después de estudiar la existencia y comportamiento de áreas específicas como anodo-cátodo-Electrólito y el mecanismo mismo de movimiento de electrones y iones, llega a ser obvio que si cada fracción del metal expuesto de una tubería o una estructura construida de tal forma de coleccionar corriente, dicha estructura no se corroerá porque sería un cátodo.
La protección catódica realiza exactamente lo expuesto forzando la corriente de una fuente externa, sobre toda la superficie de la estructura.
Mientras que la cantidad de corriente que fluye, sea ajustada apropiadamente venciendo la corriente de corrosión y, descargándose desde todas las áreas anódicas, existirá un flujo neto de corriente sobre la superficie, llegando a ser toda la superficie un cátodo.
Para que la corriente sea forzada sobre la estructura, es necesario que la diferencia de potencial del sistema aplicado sea mayor que la diferencia de potencial de las microceldas de corrosión originales.
La protección catódica funciona gracias a la descarga de corriente desde una cama de ánodos hacia tierra y dichos materiales están sujetos a corrosión, por lo que es deseable que dichos materiales se desgasten (se corroan) a menores velocidades que los materiales que protegemos.
Teóricamente, se establece que el mecanismo consiste en polarizar el cátodo, llevándolo mediante el empleo de una corriente externa, más allá del potencial de corrosión, hasta alcanzar por lo menos el potencial del ánodo en circuito abierto, adquiriendo ambos el mismo potencial eliminándose la corrosión del sitio, por lo que se considera que la protección catódica es una táctica de polarización catódica.
La protección catódica no elimina la corrosión, éste remueve la corrosión de la estructura a ser protegida y la concentra en un punto donde se descarga la corriente.
Para su funcionamiento práctico requiere de un electrodo auxiliar (ánodo), una fuente de corriente contínua cuyo terminal positivo se conecta al electrodo auxiliar y el terminal negativo a la estructura a proteger, fluyendo la corriente desde el electrodo a través del electrólito llegando a la estructura.
Influyen en los detalles de diseño y construcción parámetro de geometría y tamaño de la estructura y de los ánodos, la resistividad del medio electrólito, la fuente de corriente, etc.
Consideraciones de diseño para la protección catódica en tuberías enterradas
La proyección de un sistema de protección catódica requiere de la investigación de características respecto a la estructura a proteger, y al medio.
Respecto a la estructura a proteger
1) Material de la estructura;
2) Especificaciones y propiedades del revestimiento protector (si existe);
3) Características de construcción y dimensiones geométricas;
4) Mapas, planos de localización, diseño y detalles de construcción;
5) Localización y características de otras estructuras metálicas, enterradas o sumergidas en las proximidades;
6) Información referente a los sistemas de protección catódica, los característicos sistemas de operación, aplicados en las estructuras aledañas;
7) Análisis de condiciones de operación de líneas de transmisión eléctrica en alta tensión, que se mantengan en paralelo o se crucen con las estructuras enterradas y puedan causar inducción de la corriente;
8) Información sobre todas las fuentes de corriente contínua, en las proximidades y pueden originar corrosión;
9) Sondeo de las fuentes de corriente alterna de baja y media tensión, que podrían alimentar rectificadores de corriente o condiciones mínimas para la utilización de fuentes alternas de energía;
Respecto al medio
Luego de disponer de la información anterior, el diseño será factible complementando la información con las mediciones de las características campo como:
1) Mediciones de la resistividad eléctrica a fin de evaluar las condiciones de corrosión a que estará sometida la estructura. Definir sobre el tipo de sistema a utilizar; galvánico o corriente impresa y, escoger los mejores lugares para la instalación de ánodos;
2) Mediciones del potencial Estructura-Electrólito, para evaluar las condiciones de corrosividad en la estructura, así mismo, detectar los problemas de corrosión electrolítica;
3) Determinación de los lugares para la instalación de ánodo bajo los siguientes principios:
a) Lugares de baja resistividad
b) Distribución de la corriente sobre la estructura
c) Accesibilidad a los sitios para montaje e inspección
4) Pruebas para la determinación de corriente necesaria; mediante la inyección de corriente a la estructura bajo estudio con auxilio de una fuente de corriente contínua y una cama de ánodos provisional. La intensidad requerida dividida para área, permitirá obtener la densidad requerida para el cálculo;
Sistemas de protección catódica
Anodo galvánico
Se fundamenta en el mismo principio de la corrosión galvánica, en la que un metal más activo es anódico con respecto a otro más noble, corroyéndose el metal anódico.
En la protección catódica con ánodo galvánicos, se utilizan metales fuertemente anódicos conectados a la tubería a proteger, dando origen al sacrificio de dichos metales por corrosión, descargando suficiente corriente, para la protección de la tubería.
La diferencia de potencial existente entre el metal anódico y la tubería a proteger, es de bajo valor porque este sistema se usa para pequeños requerimientos de corriente, pequeñas estructuras y en medio de baja resistividad.
Características de un ánodo de sacrificio
1) Debe tener un potencial de disolución lo suficientemente negativo, para polarizar la estructura de acero (metal que normalmente se protege) a -0,8 V. Sin embargo el potencial no debe de ser excesivamente negativo, ya que eso motivaría un gasto superior, con un innecesario paso de corriente. El potencial práctico de disolución puede estar comprendido entre -0,95 a -1,7 V;
2) Corriente suficientemente elevada, por unidad de peso de material consumido;
3) Buen comportamiento de polarización anódica a través del tiempo;
4) Bajo costo
Tipos de ánodos
Considerando que el flujo de corriente se origina en la diferencia de potencial existente entre el metal a proteger y el ánodo, éste último deberá ocupar una posición más elevada en la tabla de potencias (serie electroquímica o serie galvánica).
Los ánodos galvánicos que con mayor frecuencia se utilizan en la protección catódica son: magnesio, cinc, aluminio.
Magnesio: Los ánodos de Magnesio tienen un alto potencial con respecto al hierro y están libres de pasivación. Están diseñados para obtener el máximo rendimiento posible, en su función de protección catódica. Los ánodos de Magnesio son apropiados para oleoductos, pozos, tanques de almacenamiento de agua, incluso para cualquier estructura que requiera protección catódica temporal. Se utilizan en estructuras metálicas enterradas en suelo de baja resistividad hasta 3.000 ohm/cm.
Cinc: Para estructura metálica inmersas en agua de mar o en suelo con resistividad eléctrica de hasta 1.000 ohm/cm.
Aluminio: Para estructuras inmersas en agua de mar.
Relleno Backfill
Para mejorar las condiciones de operación de los ánodos en sistemas enterrados, se utilizan algunos rellenos entre ellos el de Backfill especialmente con ánodos de cinc y magnesio, estos productos químicos rodean completamente el ánodo produciendo algunos beneficios como:
- Promover mayor eficiencia;
- Desgaste homogéneo del ánodo;
- Evita efectos negativos de los elementos del suelo sobre el ánodo;
- Absorben humedad del suelo manteniendo dicha humedad permanente
La composición típica del Backfill para ánodos galvánicos está constituida por yeso (CaSO₄), bentonita, sulfato de sodio, y la resistividad de la mezcla varía entre 50 a 250 ohm/cm.
Diseño de instalación para ánodo galvánico
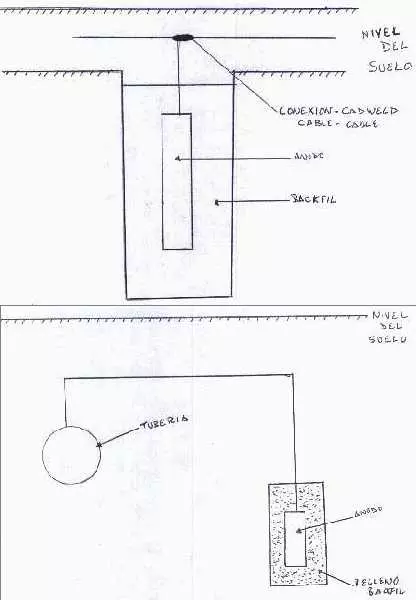
Esquema del diseño
Características de los ánodos galvánicos
| Anodo | Eficiencia | Rendimiento am-hr/kg | Contenido de energía am-hr/kg | Potencial de trabajo (volt) | Relleno |
| Cinc | 95 % | 778 | 820 | -1,10 | 50 % yeso 50 % bentonita |
| Magnesio | 95 % | 1.102 | 2.204 | -1,45 a -1,70 | 75 % yeso 20 % bentonita 5 % SO₄Na₂ |
| Aluminio | 95 % | 2.817 | 2.965 | -1,10 |
Corriente impresa
En este sistema se mantiene el mismo principio fundamental, pero tomando en cuenta las limitaciones del material, costo y diferencia de potencial con los ánodos de sacrificio, se ha ideado este sistema mediante el cual el flujo de corriente requerido, se origina en una fuente de corriente generadora contínua regulable o, simplemente se hace uso de los rectificadores, que alimentados por corriente alterna ofrecen una corriente eléctrica contínua apta para la protección de la estructura.
La corriente externa disponible es impresa en el circuito constituido por la estructura a proteger y la cama anódica. La dispersión de la corriente eléctrica en el electrólito se efectúa mediante la ayuda de ánodos inertes cuyas características y aplicación dependen del electrólito.
El terminal positivo de la fuente debe siempre estar conectado a la cama de ánodo, a fin de forzar la descarga de corriente de protección para la estructura.
Este tipo de sistema trae consigo el beneficio de que los materiales a usar en la cama de ánodos se consumen a velocidades menores, pudiendo descargar mayores cantidades de corriente y mantener una vida más amplia.
En virtud de que todo elemento metálico conectado o en contacto con el terminal positivo de la fuente e inmerso en el electrólito es un punto de drenaje de corriente forzada y, por lo tanto, de corrosión, es necesario el mayor cuidado en las instalaciones y la exigencia de la mejor calidad en los aislamientos de cables de interconexión
Anodos utilizados en la corriente impresa
Chatarra de hierro: Por su economía es a veces utilizado como electrodo dispersor de corriente. Este tipo de ánodo puede ser aconsejable su utilización en terrenos de resistividad elevada y es aconsejable se rodee de un relleno artificial constituido por carbón de coque. El consumo medio de estos lechos de dispersión de corriente es de 9 kg/A·año
Ferrosilicio: Este ánodo es recomendable en terrenos de media y baja resistividad. Se coloca en el suelo hincado o tumbado rodeado de un relleno de carbón de coque. A intensidades de corriente baja de 1 A, su vida es prácticamente ilimitada, siendo su capacidad máxima de salida de corriente de unos 12 a 15 A por ánodo. Su consumo oscila a intensidades de corriente altas, entre 0,5 a 0,9 kg/A·año. Su dimensión más normal es la correspondiente a 1.500 mm de longitud y 75 mm de diámetro.
Grafito: Puede utilizarse principalmente en terrenos de resistividad media y se utiliza con relleno de grafito o carbón de coque. Es frágil, por lo que su transporte y embalaje debe ser de cuidado. Sus dimensiones son variables, su longitud oscila entre 1.000-2.000 mm, y su diámetro entre 60-100 mm, son más ligeros de peso que los ferrosilicios. La salida máxima de corriente es de 3 a 4 ampere por ánodo, y su desgaste oscila entre 0,5 y 1 kg/A·año
Titanio-Platinado: Este material está especialmente indicado para instalaciones de agua de mar, aunque sea perfectamente utilizado en agua dulce o incluso en suelo. Su característica más relevante es que a pequeños voltajes (12 V), se pueden sacar intensidades de corriente elevada, siendo su desgaste perceptible. En agua de mar tiene, sin embargo, limitaciones en la tensión a aplicar, que nunca puede pasar de 12 V, ya que ha tensiones más elevadas podrían ocasionar el despegue de la capa de óxido de titanio y, por lo tanto, la deterioración del ánodo. En aguas dulce que no tengan cloruro pueden actuar estos ánodos a tensiones de 40-50 V.
Fuente de corriente
El rectificador
Es un mecanismo de transformación de corriente alterna a corriente contínua, de bajo voltaje mediante la ayuda de diodos de rectificación, comúnmente de selenio o silicio y sistemas de adecuación regulable manual y/o automática, a fin de regular las características de la corriente, según las necesidades del sistema a proteger
Las condiciones que el diseñador debe estimar para escoger un rectificador son:
1) Características de la corriente alterna disponible en el área (volt, ciclos, fases);
2) Requerimiento máximo de salida en CA (ampere y volt);
3) Sistemas de montaje: sobre el piso, empotrado en pared, en un poste;
4) Tipos de elementos de rectificación: selenio, silicio;
5) Máxima temperatura de operación;
6) Sistema de seguridad: alarma, breaker, etc;
7) Instrumentación: voltímetros y amperímetros, sistemas de regulación;
Otras fuentes de corrientes
Es posible que habiendo decidido utilizar el sistema de corriente impresa, no se disponga en la zona de líneas de distribución de corriente eléctrica, por lo que sería conveniente analizar la posibilidad de hacer uso de otras fuentes como:
- Baterías, de limitada aplicación por su bajo drenaje de corriente y vida limitada;
- Motores generadores;
- Generadores termoeléctricos;
Comparación de los sistemas
A continuación se detalla las ventajas y desventajas de los sistemas de protección catódica.
| Anodos galvánicos | Corriente impresa |
| No requieren potencia externa. Voltaje de aplicación fijo Amperaje limitado | Requiere potencia externa. Voltaje de aplicación variable Amperaje variable |
| Aplicable en casos de requerimiento de corriente pequeña, económico hasta 5 ampere | Util en diseño de cualquier requerimiento de corriente sobre 5 ampere; |
| Util en medios de baja resistividad | Aplicables en cualquier medio; |
| La interferencia con estructuras enterradas es prácticamente nula | Es necesario analizar la posibilidad de interferencia; |
| Sólo se los utiliza hasta un valor límite de resistividad eléctrica hasta 5.000 ohm/cm | Sirve para áreas grandes |
| Mantenimiento simple | Mantenimiento no simple Resistividad eléctrica ilimitada. Costo alto de instalación |
Medias celdas de referencia
La fuerza electromotriz (FEM) de una media celda como constituye el sistema Estructura-Suelo o independientemente el sistema cama de Anodos-Suelo, es posible medirla mediante la utilización de una media celda de referencia en contacto con el mismo electrólito.
Las medias celdas más conocidas en el campo de la protección catódica son:
- Hidrógeno o calomelo (H⁺/H₂)
- Cinc puro (Zn/Zn²⁺)
- Plata-cloruro de plata (Ag/AgCl)
- Cobre-sulfato de cobre (Cu/SO₄Cu)
La media celda de Hidrógeno tiene aplicación práctica a nivel de laboratorio por lo exacto y delicado. También existen instrumentos para aplicación de campo, constituida por solución de mercurio, cloruro mercurioso, en contacto con una solución saturada de cloruro de potasio que mantiene contacto con el suelo.
La media celda de cinc puro para determinaciones en suelo, siendo condición necesaria para el uso un grado de pureza de 99,99 %, es utilizado en agua bajo presiones que podrían causar problemas de contaminación en otras soluciones y también como electrodos fijos.
La media celda plata-cloruro de plata de poco uso pese a ser muy estable, se utilizan especialmente en instalaciones marinas. Más comúnmente utilizados en los análisis de eficiencia de la protección catódica son las medias celdas de Cobre-Sulfato de cobre debido a su estabilidad y su facilidad de mantenimiento y reposición de solución
La protección del acero bajo protección catódica se estima haber alcanzado el nivel adecuado cuando las lecturas del potencial-estructura-suelo medidos con las diferentes celdas consiguen los siguientes valores:
| Electrodo | Lectura |
| Ag-AgCl Cu-SO₄Cu Calomel Zn puro | -0,800 V -0,850 V -0,77 V +0,25 V |
Criterios de protección
Cuando se aplica protección catódica a una estructura, es extremadamente importante saber si esta se encontrará realmente protegida contra la corrosión en toda su plenitud.
Varios criterios pueden ser adoptados para comprobar que la estructura en mención está exenta de riesgo de corrosión, basados en unos casos en función de la densidad de corriente de protección aplicada y otros en función de los potenciales de protección obtenidos.
No obstante, el criterio más apto y universalmente aceptado es el de potencial mínimo que debe existir entre la estructura y terreno, medición que se realiza con un electrodo de referencia. El criterio de potencial mínimo se basa en los estudios realizados por el Profesor Michael Pourbaix, en 1.939, quién estableció a través de un diagrama de potencial de electrodo Vs pH del medio, un potencial mínimo equivalente a -850 mv con relación al electrodo de referencia cobre-sulfato de cobre, observando una zona definida por la inmunidad del acero.
Los criterios de potencial mínimo de protección que se utilizará es de -850 mv respecto al Cu/SO₄Cu como mínimo y permitiendo recomendar así mismo, un máximo potencial de protección que pueda estar entre los 1.200 mv a -1.300 mv, sin permitir valores más negativos, puesto que se corre el riesgo de sobre protección, que afecta de sobre manera al recubrimiento de la pintura, ya que hay riesgos de reacción catódica de reducción de hidrógeno gaseoso que se manifiesta como un ampollamiento en la pintura.
Resistividad del suelo
Cuando se diseña protección catódica o simplemente cuando se estudia la influencia de la corrosión en un medio en el cual se instalará equipos o se tenderá una línea, es necesario investigar las características del medio, entre estas características, relacionada directamente con el fenómeno corrosivo se encuentra la resistividad del medio.
La resistividad es la recíproca de la conductividad o capacidad del suelo para conducir corriente eléctrica. En la práctica se ejecutan medidas de resistencia de grandes masas de material y se calcula un valor promedio para el mismo.
Las áreas de menor resistividad son las que tienden a crear zonas anódicas en la estructura, pero así mismo son las zonas más aptas para instalación de las camas de ánodos
En la práctica se realiza esta medida empleando un voltímetro y un amperímetro o bien instrumentos especiales como el Vibro-Graund complementados mediante un equipo de cuatro picas o electrodo directamente en el campo y mediante el Soil Box en laboratorio.
Cuando se ejecuta en el campo, el método consiste en introducir en el suelo 4 electrodos separados por espaciamientos iguales, los espaciamientos representan la profundidad hasta lo que se desea conocer la resistividad este espaciamiento se lo representa con (d).
Se calcula la resistividad aplicando la siguiente fórmula:
rs = 2·3,1416·d·R (R = resistencia).
| Resistividad ohm/cm | Características |
| Bajo 900 900 a 2.300 2.300 a 5.000 5.000 a 10.000 Sobre 10.000 | Muy corrosivo Corrosivo Moderadamente corrosivo Medio corrosivo Menos corrosivo |
Conclusiones:
Como conclusiones tenemos los siguientes puntos:
1) El proceso de corrosión debe ser visto como un hecho que pone en evidencia el proceso natural de que los metales vuelven a su condición primitiva y que ello conlleva al deterioro del mismo. No obstante es este proceso el que provoca la investigación y el planteamiento de fórmulas que permitan alargar la vida útil de los materiales sometidos a este proceso
2) En la protección catódica entran en juego múltiples factores los cuales hay que tomar en cuenta al momento del diseño del sistema, inclusive es un acto de investigación conjunta con otras disciplinas más allá de la metalurgia, como la química y la electrónica
3) En el trabajo se confirma que la lucha y control de la corrosión es un arte dentro del mantenimiento y que esta área es bastante amplia, dado el sinnúmero de condiciones a los cuales se encuentran sometidos los metales que forman equipos y herramientas
4) Como última conclusión está el hecho de que hay que ahondar en estos conocimientos pues ellos formarán parte integral de la labor que debe desempeñar un Ingeniero de Mantenimiento
Bibliografía:
- Introducción A La Metalúrgica Física, Sidney H. Avner
- Sistemas De Protección Catódica, Elizabeth García. Universidad de Sonora. México.
Autor: Oscar González.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
¿Cuáles son las causas de la corrosión? ¿Qué es la protección anódica? ¿Qué es la protección catódica y cómo funciona?