Celda voltaica
Una celda voltaica aprovecha la electricidad de la reacción química espontánea para encender una lamparita, es decir, convierte energía potencial química en energía eléctrica.
Las tiras de cinc y cobre, dentro de disoluciones de ácido sulfúrico diluido y sulfato de cobre respectivamente, actúan como electrodos (el derecho actúa como cátodo y el izquierdo como ánodo - figura 1).
El puente salino (en este caso cloruro de potasio) permite a los electrones fluir entre las cubetas sin que se mezclen las disoluciones. Cuando el circuito entre los dos sistemas se completa (como se muestra a la figura 2), la reacción genera una corriente eléctrica.
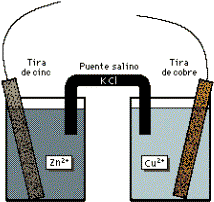
Figura 1: Esquema de una pila voltaica
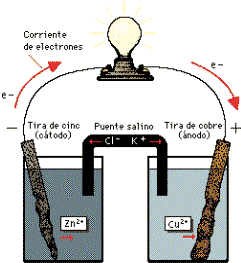
Figura 2: Circulación de electrones en una pila voltaica
Si ambas soluciones se conectan mediante un voltímetro su lectura acusará 1,10 V, esto debido a que el potencial de oxidación del Zn²⁺ es 0,763 V y el del Cu²⁺ es de -0,337 V, por lo tanto, el cinc (de mayor potencial) le cede electrones al cobre (de menor potencial).
Obsérvese que el metal de la tira de cinc se consume (oxidación) y la tira desaparece. La tira de cobre crece al reaccionar los electrones con la disolución de sulfato de cobre para producir metal adicional (reducción). Si se sustituye la lamparita por una batería la reacción de una se invertirá, creando una celda electrolítica, convirtiendo energía eléctrica en energía potencial química.
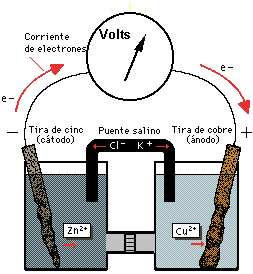
Medición de la tensión en una pila voltaica
Las semireacciones correspondientes son:
Anodo:
Zn° ⟶ Zn²⁺ + 2·e⁻
Cátodo:
Cu²⁺ + 2·e ⟶ Cu°
Una celda voltaica es un dispositivo para producir energía eléctrica a partir de una reacción redox. La principal característica de la celda voltaica es la pared porosa que separa las dos soluciones evitando que se mezclen. La pared es porosa para que los iones la atraviesen. La hemicelda del ánodo adquiere un exceso de iones de Zn positivos (para mantener la neutralidad eléctrica necesita iones negativos), al mismo tiempo, la hemicelda del cátodo consume iones de Cu (para mantener la neutralidad,éste debe eliminar iones negativos). Los iones SO₄⁼ atraviesan la pared porosa para satisfacer la neutralidad eléctrica de ambas hemiceldas. Los tipos de celdas más comunes son: las pilas y el acumulador de plomo.
Potenciales: No hay manera de medir la energía potencial de una hemicelda, sin embargo, la diferencia de potencial entre dos hemiceldas de una celda voltaica puede medirse con un voltímetro. Esta diferencia de potencial es una medida de la tendencia relativa de las dos sustancias para absorber electrones. Si a la hemicelda de cobre se le asigna arbitrariamente un potencial de cero, se dice que la hemicelda de cinc tiene un potencial de -1,10 V, el signo negativo, indica que es menos probable que los iones de cinc absorban electrones que los iones cobre. En cambio, si le asignamos potencial cero a la hemicelda de cinc, el cobre tendrá potencial +1,10 V.
En la práctica, se le asigna potencial cero a la hemicelda de hidrógeno, esta se compone de una lámina de platino, y se introduce en una solución de iones hidrógeno (H⁺) uno molar. Se hace burbujear hidrógeno gaseoso en la solución alrededor del platino (el hidrógeno gaseoso procede de un cilindro cuya presión es de 1 atm). Las moléculas de H₂ se adsorben sobre la superficie del platino y forman el electrodo. La semirreacción es:
H⁺ + e⁻ ⇌ ½·H₂
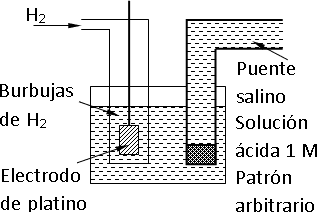
Esquema de una celda voltaica
Si se utiliza la hemicelda de hidrógeno con la de cinc, el potencial será de - 0,76 V. Si se utiliza la hemicelda de hidrógeno con la de cobre, el potencial será de + 0,34 V. De esta manera se determinan experimentalmente los potenciales de casi todas las reacciones redox (ver tabla). A estos valores se los denomina potenciales electroquímicos normales
Potenciales de reducción normales de semireacciones
| Semirreacción | volt | ||
|---|---|---|---|
| Agentes oxidantes débiles | Li⁺ + e ⟶ Li | - 3,05 | Agentes reductores fuertes |
| ½·Mg²⁺ + e ⟶ ½·Mg | -2,37 | ||
| ½·Mn²⁺ + e ⟶ ½·Mn | -1,18 | ||
| ½·Zn²⁺ + e ⟶ ½·Zn | -0,76 | ||
| ⅓·Cr³⁺ + e ⟶ ⅓·Cr | - 0,74 | ||
| ½·Fe³⁺ + e ⟶ ½·Fe | - 0,44 | ||
| ½·Ni²⁺ + e ⟶ ½·Ni | - 0,24 | ||
| ½·Sn²⁺ + e ⟶ ½·Sn | - 0,14 | ||
| ½·Pb²⁺ + e ⟶ ½·Pb | - 0,13 | ||
| ⇓ | 2·H⁺ + e ⟶ H₂ | 0,00 | ⇑ |
| Agentes oxidantes fuertes | ½·Sn⁴⁺ + e ⟶ ½·Sn²⁺ | 0,15 | Agentes reductores débiles |
| Cu²⁺ + e ⟶ Cu⁺ | 0,15 | ||
| ½·SO₄⁼ + 2·H⁺ + e ⟶ ½·SO₂ + H₂O | 0,20 | ||
| ½·Cu²⁺ + e ⟶ ½·Cu | 0,34 | ||
| Cu⁺ + e ⟶ Cu | 0,52 | ||
| Ag⁺ + e ⟶ Ag | 0,80 | ||
| NO₃⁻ + 4·H⁺ + e ⟶ NO + 2·H₂O | 0,96 | ||
| MnO₄⁻ + 8·H⁺ + e ⟶ Mn²⁺ + 4·H₂O | 1,49 |
Concentraciones iónicas, 1 M en agua a 25 °C
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué pasa en una celda electrolítica?