Los iones
Los iones son componentes esenciales de la materia tanto inerte como viva. Son partículas con carga eléctrica neta que participan en un buen número de fenómenos químicos. A la temperatura ambiente, los iones de signo opuesto se unen entre sí fuertemente siguiendo un esquema regular y ordenado que se manifiesta bajo la forma de un cristal. En disolución, son la base de procesos como la electrólisis y el fundamento de aplicaciones como las pilas y los acumuladores.
Aun cuando la materia se presenta la mayor parte de las veces carente de propiedades eléctricas, son éstas las responsables, en gran medida, de su constitución y estructura. Un grano de sal, una gota de limón o un trozo de mármol contienen millones de átomos o conjuntos de átomos que han perdido su neutralidad eléctrica característica y se han convertido en iones.
Las fuerzas eléctricas entre iones de signo opuesto son las responsables del aspecto sólido y consistente que ofrece un cristal de cloruro de sodio. La composición iónica de una gota de limón hace de ella un conductor de la corriente eléctrica, siendo los iones presentes en la disolución los portadores de carga y energía eléctricas. Los procesos químicos en los cuales las sustancias reaccionantes ceden o captan electrones implican la formación de iones o su neutralización. El enlace iónico, la electrólisis y los procesos de oxidación-reducción son algunos de los fenómenos naturales en los que los iones desempeñan el papel principal.
¿Qué son los iones?
Un poco de historia
El estudio de la composición de las sustancias químicas llevó al químico inglés Humphrey Davy (1.778 - 1.829) a investigar la influencia de la corriente eléctrica en la separación de diferentes sustancias compuestas. Ensayó infructuosamente con sustancias sólidas para más tarde probar con las mismas sustancias fundidas. El paso de la corriente alimentada por una potente batería construida a propósito permitió finalmente a Davy separar diferentes compuestos en sus elementos constituyentes.
Michael Faraday (1.791 - 1.867), discípulo de Davy, extendió los estudios de su maestro a disoluciones e introdujo, por primera vez, el nombre de electrólisis para referirse a la separación o ruptura de sustancias compuestas mediante la corriente eléctrica. La observación de que las disoluciones salinas eran capaces de conducir la corriente eléctrica llevó a Faraday a considerar que deberían existir en tales disoluciones partículas cargadas cuyo movimiento entre los dos conductores extremos o electrodos, colocados dentro de la disolución, constituiría la corriente eléctrica. A tales partículas cargadas las llamó iones, que en griego significa viajero. El electrodo positivo recibió el nombre de ánodo; hacia él viajarían los iones negativos que llamó aniones. Por su parte el electrodo negativo o cátodo atraería a los iones positivos, que por dirigirse al cátodo los denominó cationes.
El concepto de ion
Un ion es un átomo o grupo de átomos cargado eléctricamente. Un ion positivo es un catión y un ion negativo es un anión.
La formación de los iones a partir de los átomos es, en esencia, un proceso de pérdida o ganancia de electrones. Así, cuando un átomo como el de sodio (Na) pierde un electrón (e⁻) se convierte (⟶) en el catión Na⁺:
Na - 1·e ⟶ Na⁺ (18.1)
Si un átomo de oxígeno gana dos electrones se convierte en el anión O⁼:
O + 2·e ⟶ O⁼ (18.2)
Cuando un ion sencillo se une con moléculas neutras o con otro ion de signo opuesto que no compensa totalmente su carga, se forma un ion complejo. Tal es el caso del ion amonio NH₄⁺ producido por la unión del ion hidrógeno con la molécula de amoníaco NH₃:
H⁺ + NH₃ ⟶ NH₄⁺
o del ion hidronio formado por la unión del ion hidrógeno con la molécula de agua H₂O:
H⁺ + H₂O ⟶ H₃O⁺
Aun cuando los iones proceden de los átomos son, desde un punto de vista químico, muy diferentes de ellos. Así, la sustancia sodio metálico, compuesta por átomos de sodio Na, reacciona enérgicamente con el agua, mientras que el ion sodio Na⁺ no lo hace. Debido a las diferencias existentes en su configuración electrónica, átomos e iones suelen presentar diferencias notables en su capacidad para reaccionar químicamente con otras sustancias.
Fuerzas de enlace iónico
La formación de cualquier compuesto a partir de los correspondientes elementos está íntimamente relacionada con la estructura interna de los átomos que han de enlazarse y, en particular, con la configuración adoptada por sus electrones más externos. En este sentido cabe hacer distinción entre los elementos metálicos y los no metálicos. Un análisis de las configuraciones electrónicas de los diferentes elementos de la tabla periódica indica que la mayor parte de los metales tienen muy pocos electrones en su última capa, mientras que en los no metales sucede todo lo contrario.
Los metales pueden deshacerse con cierta facilidad de sus electrones más externos, dando lugar a iones de signo positivo o cationes; se dice por ello que son electropositivos; en tanto que los no metales tienden a incorporar electrones en su última capa convirtiéndose en iones de signo negativo o aniones, razón por la que son considerados como elementos electronegativos. Ambos hechos son debidos a que las configuraciones electrónicas formadas por capas completas son más estables, es decir, implican una menor energía potencial, por lo que los átomos de los diferentes elementos presentan cierta tendencia a alcanzar tal situación, que es característica de los gases nobles.
La formación del enlace iónico
El arrancar un electrón a un átomo es un proceso que implica el consumo de una determinada cantidad de energía o energía de ionización que resulta relativamente pequeña en los metales. Tomando como referencia un metal y un no metal, como son el sodio y el cloro, se tiene:
Na + energía ionización ⟶ Na⁺ + 1·e⁻
(8,2·10⁻¹⁹ J/átomo)
Cl + energía ionización ⟶ Cl⁺ + 1·e⁻
(20,8·10⁻¹⁹ J/átomo)
La incorporación de un electrón a un no metal típico para formar un ion negativo estable lleva consigo, por el contrario, la liberación de una cantidad de energía denominada afinidad electrónica o electroafinidad. Así:
Cl + 1·e ⟶ Cl⁻ + afinidad electrónica.
(5,8·10⁻¹⁹ J/átomo)
Parece, pues, lógico suponer que, si se dan las condiciones oportunas, ambos procesos tiendan a acoplarse para, a partir de los átomos Na y Cl, obtener simultáneamente los iones Na⁺ y Cl⁻ con configuraciones electrónicas estables ([Na⁺] = [Ne]; [Cl⁺] = [Ar]). Sin embargo, debido a que la afinidad electrónica del Cl es inferior a la energía de ionización del Na, para que el proceso global se lleve a término es necesario un aporte suplementario de energía.
Una vez formados ambos iones, y al ser éstos de signos opuestos, se produce una atracción electrostática entre ellos que da lugar a la liberación de una cantidad de energía considerable por disminución de la energía potencial electrostática del conjunto, lo que hace posible la formación de nuevos pares iónicos y de nuevos enlaces. Los enlaces iónicos entre pares de elementos se darán, pues, cuando cada uno de ellos tienda a generar iones de signo contrario; ésta es la característica que presentan precisamente los metales respecto de los no metales.
La descripción energética del enlace iónico
La energía potencial electrostática Eₚ entre dos cargas Q y q viene dada por la expresión:
![]()
Siendo positiva para fuerzas repulsivas (cargas de igual signo) y negativa para fuerzas atractivas (cargas de signo contrario). La representación gráfica de Eₚ con la distancia r tiene la forma de una hipérbola equilátera como corresponde a una función que varía con 1/r.
Recurriendo a los diagramas de energía potencial electrostática para fuerzas atractivas y repulsivas es posible interpretar la situación de enlace iónico en términos energéticos. Las fuerzas electrostáticas atractivas entre dos iones de signo contrario aumentan al disminuir la distancia, pero la fuerza repulsiva entre sus respectivos núcleos y capas electrónicas completas pone un límite a este proceso de aproximación estableciendo una distancia de equilibrio entre ambas fuerzas electrostáticas de signo contrario y otorgando una cierta estabilidad al enlace.
Tal situación queda resumida en el diagrama de energía de enlace representado en la figura siguiente (derecha). La parte (a) de la curva de energía potencial pone de manifiesto que las fuerzas que operan entre ambos iones a distancias inferiores a r₀ son repulsivas. La parte (b) corresponde a fuerzas atractivas de modo que el valor r = r₀ fija la distancia de equilibrio caracterizada por un mínimo de energía potencial para el par iónico ligado.
Sólidos iónicos
Cristales iónicos
Las fuerzas de enlace iónico son típicamente electrostáticas, de modo que un ion Na⁺ ejercerá su fuerza atractiva sobre los iones Cl⁻ con igual intensidad en todas las direcciones del espacio para una distancia dada. Esta característica de las fuerzas de enlace iónico da lugar a la formación de estructuras iónicas espaciales y regulares en las que cada ion está ligado a un grupo ordenado de iones de signo contrario que le rodea. Dicho número, que se conoce con el nombre de índice de coordinación, estará determinado fundamentalmente por la relación que exista entre los tamaños de los iones enlazados. Así, por ejemplo, en el cristal de NaCl el índice de coordinación es 6, la estructura de su red cristalina es cúbica centrada en las caras y cada ion Na⁺ está rodeada por 6 Cl⁻. Sin embargo, en el cristal del CsCl el índice de coordinación es 8 y la estructura de su red cristalina es cúbica centrada en el cuerpo; en ella cada ion Cs⁺ está rodeado por 8 Cl⁻.
Esta diferente estructura de ambos cristales puede explicarse como debida a que el tamaño de un ion Cl⁻ es casi el doble que el de un ion Na⁺ y, sin embargo, es sólo un poco mayor que el de un ion Cs⁺. Dado que la estructura más estable es la más compacta posible, es lógico que en torno a un ion mayor como es el Cs⁺ tengan que agruparse un mayor número de iones Cl⁻. Para comprender mejor este hecho basta asimilar los iones a esferas y considerar cómo influiría el tamaño de las mismas en la formación de una estructura compacta.
Todo cristal iónico ha de ser, en conjunto, eléctricamente neutro, y por esta razón se escriben las fórmulas de los compuestos iónicos como si se tratase de moléculas cuando en realidad no lo son. Así, cuando se escribe el cloruro de cesio como CsCl se quiere indicar con ello que, en conjunto e independientemente de su ordenación en el cristal, existe un ion Cs⁺ por cada ion Cl⁻. De igual modo, cuando los iones en cuestión difieren en su número de cargas, la fórmula se verá afectada por los correspondientes subíndices que indican la proporción de uno a otro exigida por la condición de electroneutralidad del cristal. Así, por ejemplo, el fluoruro de calcio (fluorita) está formado por la unión iónica de los iones F⁻ y Ca²⁺; su fórmula viene dada por CaF₂
Propiedades de los sólidos iónicos
El hecho de que las fuerzas electrostáticas responsables del enlace iónico sean intensas y estén orientadas en las diferentes direcciones del espacio determina la mayor parte de las propiedades características de estos sólidos. Así, por ejemplo, todos los compuestos iónicos presentan un elevado punto de fusión por encima de los 500 °C la mayoría de las veces, de modo que en las condiciones de presión y temperatura ordinarias se hallan en estado sólido. Sólo a altas temperaturas la energía térmica, que se traduce en vibración de los iones en la red, es suficiente como para vencer las fuerzas de enlace, con lo que la estructura cristalina se viene abajo y el sólido iónico se convierte en líquido.
Los sólidos iónicos se caracterizan por su dureza o dificultad para ser rayados, así como por su fragilidad, es decir, por su carácter quebradizo. Teniendo en cuenta que todo proceso de rayado implica la rotura de enlaces en el cristal, se comprenderá por qué tal operación resulta dificultosa en los compuestos iónicos; es una consecuencia de la intensidad de las fuerzas de enlace. La fragilidad se explica del siguiente modo: si las fuerzas deformadoras están dirigidas de forma que produzcan un desplazamiento lateral de una capa iónica sobre otra, los iones del mismo signo quedan enfrentados, por lo que experimentarán una fuerte repulsión y el cristal se romperá.
Los compuestos iónicos no son conductores de la electricidad en estado sólido, pues los iones están fuertemente ligados en la red; sin embargo, a una temperatura superior a su punto de fusión, cuando alcanzan la condición de líquido, se convierten en conductores. En tal circunstancia son los propios iones los portadores de carga que contribuyen a la formación de una corriente eléctrica, cuando se les somete a la acción de un campo eléctrico.
Asimismo, la estructura en forma de red o retícula característica de los sólidos iónicos puede quedar deshecha bajo la acción de algunos líquidos o disolventes polares como el agua. La desaparición de las uniones rígidas entre los iones que formaban la red cristalina confiere a aquéllos, en disolución, la suficiente movilidad como para poder contribuir al transporte de carga típico de la corriente eléctrica. Esta es otra propiedad característica de los sólidos iónicos, la de ser buenos conductores en disolución.
Iones en disolución
La electrólisis
Cuando un sólido iónico es disuelto en agua, sus iones componentes pueden moverse bajo la influencia de fuerzas eléctricas. Si éstas son de signo opuesto será posible entonces separar los aniones de los cationes presentes en la disolución. Esta separación de sustancias por medio de la electricidad es lo que Faraday denominó electrólisis.
A modo de ejemplo se consideran en lo que sigue los procesos de electrólisis de sendos compuestos iónicos en disolución acuosa, el cloruro de sodio o sal común (NaCl) y el nitrato de plomo (II), cuya fórmula química viene dada por Pb(NO₃)₂, y que pueden ser estudiados experimentalmente mediante un dispositivo como el que se muestra en la figura adjunta.
La disociación del sólido iónico Pb(NO₃)₂ en sus iones componentes por mediación del agua puede escribirse en la forma:
Pb(NO₃)₂ ⟶ Pb²⁺ + 2·NO₃⁻ (18.3)
Pb²⁺ y NO₃⁻ deben ser, en principio, las partículas cargadas que viajan por la disolución hacia sus respectivos electrodos. Si como se observa experimentalmente, en el electrodo negativo o de cobre se deposita plomo, el gas incoloro que se desprende del electrodo positivo o de carbono debe proceder del NO₃⁻ o del producto de alguna reacción de éste con el agua de la disolución.
Por su parte, la electrólisis del cloruro de sodio produce en el electrodo de cobre un gas incoloro, inodoro e inflamable y en el electrodo de carbono un gas de color amarillo verdoso que puede identificarse con el cloro.
La ecuación química que describe la disociación del NaCl en agua puede escribirse en la forma:
NaCl ⟶ Na⁺ + Cl⁻ (18.4)
El hecho de que no se aprecie un depósito de sodio en el electrodo de cobre y sí un desprendimiento gaseoso, indica que tiene lugar algún proceso químico más complejo. En lo que sigue detendremos nuestra atención, por su sencillez, en lo que sucede en el electrodo de cobre de la electrólisis del Pb(NO₃)₂ y en el electrodo de carbono de la electrólisis del NaCl.
Cuando los iones Pb²⁺ atraídos por el cátodo alcanzan la superficie del cobre reciben dos electrones de éste y se convierten en plomo metálico, es decir:
Pb²⁺+ 2·e ⟶ Pb (18.5)
Por su parte, cuando los iones Cl⁻ alcanzan el electrodo de carbono o ánodo ceden un electrón y se convierten en cloro gaseoso:
2·Cl⁻ ⟶ Cl₂ (gas) + 2·e⁻ (18.6)
Cabe preguntarse por qué motivo no se producen reacciones tan directas en los electrodos de carbono y cobre con los iones NO₃⁻ y Na⁺ respectivamente. La razón es de tipo energético. Mientras que los procesos representados por las expresiones (18.5) y (18.6) requieren poca energía, los correspondientes en cada caso a los iones de signo opuesto requieren mayor cantidad de energía que otros más complejos que implican la participación del agua de la disolución y que son los responsables de un desprendimiento de oxígeno en el electrodo de carbono en la electrólisis del Pb(NO₃)₂ y de hidrógeno en el electrodo de cobre en la del NaCl.
El depósito de iones metálicos en el cátodo de una cuba electrolítica constituye el fundamento de una de las aplicaciones industriales de la electrólisis. Un objeto de metal de baja calidad puede recubrirse con una capa fina de un metal valioso mejorando de este modo su apariencia y protegiéndolo de la corrosión. Para ello se emplea dicho objeto metálico como cátodo y se recurre a una disolución electrolítica que contenga como catión el metal con el que se desea bañar el objeto y a un ánodo formado por dicho metal. Activada la electrólisis mediante la correspondiente fuente de alimentación de corriente contínua, se consigue trasvasar el metal valioso de uno a otro electrodo a través de la disolución. El cromado, el plateado o el niquelado son algunos ejemplos de recubrimiento electrolítico con metales que se conoce también como galvanostegia.
Las leyes de Faraday
Estudios sistemáticos del fenómeno de la electrólisis llevaron a Faraday a descubrir la existencia de una relación de proporcionalidad directa entre la cantidad de sustancia que se separa o se deposita en los electrodos y el producto de la intensidad de corriente que pasa por la disolución por el tiempo que dura dicha corriente. Además estableció que la cantidad de electricidad (carga eléctrica) necesaria para depositar una masa del ion considerado igual al cociente entre su mol y su carga neta es la misma para todas las sustancias e igual al faraday.
Ambas conclusiones se conocen como leyes de Faraday y en términos matemáticos pueden ser expresadas mediante una sola relación en la forma:
![]() (18.7)
(18.7)
Donde n es el número de moles depositados en el electrodo, I·t es la carga total en coulomb que circula por la disolución y F es esa cantidad de carga denominada faraday, que equivale a la carga eléctrica de un mol de electrones, es decir:
1 faraday = NA e⁻ = 96.486 C
Finalmente e representa, en la fórmula, el número de cargas del ion en cuestión.
Aplicación de las leyes de Faraday
Se desea recubrir electrolíticamente una moneda metálica con una capa de cobre, para lo cual se necesita que se depositen sobre ella 1,200 g de cobre metálico. Se emplea como cátodo la moneda y como electrólito una disolución de sulfato de cobre (II) (CuSO₄) y se aplica a la cuba una tensión eléctrica que produce una corriente de 0,4 A. Calcúlese el tiempo que debe durar el proceso para conseguir el depósito deseado. (Masa atómica del cobre: MCu = 63,54).
De acuerdo con las leyes de Faraday:
![]()
"n" es el número de moles depositados en la moneda, que en este caso se obtendrá de la forma:
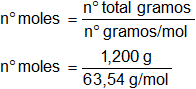
n° de moles = 1,89·10⁻² moles
"e" es el número de carga del ion que se deposita, que para el cobre
(Cu²⁺ + 2·e ⟶ Cu) es igual a 2.
F es el valor del faradio como unidad de carga, es decir, F = 96.486 C.
I es la intensidad de corriente igual a 0,4 A.
Sustituyendo los valores anteriores en la expresión de t resulta:
![]()
t = 9.118 s ≈ 152 min
Oxidación y reducción
Los procesos de oxidación-reducción
Los procesos que tienen lugar en los electrodos de una cuba electrolítica constituyen un tipo de procesos químicos denominados de oxidación y reducción.
Se dice que un ion o un elemento se oxida cuando cede uno o varios electrones. Así el ion Cl⁻ se oxida en el ánodo y pasa a cloro atómico (Cl):
Cl⁻ ⟶ Cl + e⁻
Otros ejemplos de oxidación asociados a la formación de iones pueden ser:
Na ⟶ Na⁺ + e⁻
Mg ⟶ Mg²⁺ + 2·e⁻
Fe ⟶ Fe³⁺ + 3·e⁻
En general, cualquier elemento metálico que pase a catión se oxida.
Se dice que un ion o un elemento se reduce cuando capta uno a varios electrones. El ion Pb²⁺ se reduce en el cátodo y pasa a Pb metálico:
Pb²⁺ + 2·e ⟶ Pb
Otros ejemplos de reducción referidos a elementos son:
Cl + e ⟶ Cl⁻
O + 2·e ⟶ O⁼
S + 2·e ⟶ S⁼
En general, cualquier elemento no metálico que pase a anión se reduce.
La noción electrónica de oxidación fue precedida en la historia de la química por otra que hacía referencia a una combinación con oxígeno. Según este concepto, el sodio y el calcio se oxidan mediante las reacciones:
2·Na + ½·O₂ ⟶ Na₂O
Ca + ½·O₂ ⟶ CaO
Los productos resultantes Na₂O y CaO se denominan óxidos metálicos. El proceso inverso mediante el cual se resta el oxígeno a un óxido recibió el nombre de reducción.
Sin embargo, los procesos clásicos de oxidación o reducción pueden ser enfocados desde un punto de vista electrónico. Se sabe que los óxidos metálicos son compuestos iónicos. Así, el Na₂O (óxido de sodio) se puede escribir como (2·Na⁺)O⁼ y el CaO (óxido de calcio) como Ca²⁺O⁼, de modo que las ecuaciones anteriores pueden descomponerse en la forma:
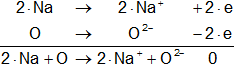
En donde los electrones liberados en el proceso de oxidación del sodio son aceptados por el oxígeno en un proceso de reducción. Análogamente:
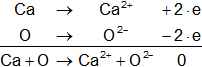
Es decir, el agente oxidante, que en este tipo de reacciones es el oxígeno, ha arrancado electrones a los átomos metálicos Na y Ca y, por tanto, los ha oxidado también desde un punto de vista electrónico. A su vez el oxígeno al ganar electrones en el proceso se ha reducido.
Los procesos de oxidación, cuando se consideran desde el punto de vista de lo que les sucede a cada uno de los elementos en juego, implican una oxidación y una reducción acopladas. Si A oxida a B, B reduce a A, de ahí que se les denomine genéricamente procesos redox (reducción-oxidación). Los procesos redox están condicionados por las energías que implican, y éstas, a la vez, por la configuración electrónica de los átomos en juego. Los metales con pocos electrones en su última capa tenderán a oxidarse para adquirir la configuración estable tipo gas noble. Los no metales, que necesitan pocos electrones para completar su última capa, tenderán a reducirse por igual motivo. De ahí que la combinación de ambos tipos de elementos, metales y no metales, esté favorecida energéticamente.
Pilas y acumuladores
Al introducir en agua acidulada una varilla de cinc unida mediante un hilo conductor a una varilla de cobre, algunos de los átomos de cinc son oxidados, pasando a formar parte de la disolución en forma de cationes Zn²⁺ según la ecuación:
Zn ⟶ Zn²⁺ + 2·e⁻ (18.8)
La oxidación tiene lugar en este electrodo y no en el de cobre debido a que el cinc presenta una mayor tendencia a ceder electrones que el cobre.
En la varilla de cobre tiene lugar una reducción de los iones hidrógeno (H⁺) de la disolución:
2·H⁺ + 2·e ⟶ H₂ (18.9)
Así, los electrones que se liberan en el electrodo de cinc (18.8) pasan a través del hilo conductor hacia el electrodo de cobre para ser captados por los iones hidrógeno (18.9), generándose una corriente eléctrica.
La varilla de cobre se comporta como un polo positivo y la de cinc como uno negativo y junto con la disolución constituyen una pila electroquímica. En ella, de forma inversa a la electrólisis, la energía química se ha transformado en energía eléctrica y los iones han jugado un papel importante en el proceso.
Este mismo tipo de reacciones redox es el fundamento de los acumuladores de plomo, componentes característicos de las baterías de automóvil. En este caso cada elemento de la batería está formado por un electrodo de plomo metálico, un electrodo de dióxido de plomo y una solución electrolítica de ácido sulfúrico
H₂SO₄ ⟶ 2·H⁺ + SO₄⁼
Las reacciones redox que acontecen en cada uno de los electrodos en el proceso de descarga son las siguientes:
En el cátodo: (-)
Pb + SO₄⁼ ⟶ PbSO₄ + 2·e⁻
(disolución)
En el ánodo: (+)
PbO₂ + SO₄⁼ + 4·H₃O⁻ + 2·e ⟶ PbSO₄ + 6·H₂O
(disolución)
Cuando la batería está conectada a un receptor el proceso de descarga correspondiente supone la circulación de los electrones a través de la disolución desde el cátodo hasta el ánodo. En el proceso de carga de la batería por el alternador o la dinamo se invierten los sentidos de los anteriores procesos redox y la energía química es restituida al sistema. Las pilas secas que se emplean habitualmente en las linternas se basan también en este mismo principio electroquímico.
La pila de Daniell
Toma el nombre de su inventor, el químico inglés John Frederich Daniell
(1.790 - 1.845), que consiguió con ella la primera fuente de tensión capaz de mantener constante la diferencia de potencial entre sus bornes durante un tiempo razonable.
Al igual que la pila galvánica, la pila Daniell está basada en los fenómenos de oxidación y reducción de dos electrodos metálicos sumergidos en una disolución iónica, sólo que en este caso tales procesos resultan independientes. Los electrodos, uno de cobre y otro de cinc, están sumergidos en sendas soluciones de sus respectivos iones separadas entre sí por un tabique poroso. Dicho tabique impide la mezcla de los dos líquidos, pero permite, sin embargo, el paso de los iones a su través y, por tanto, la conducción eléctrica. El proceso de oxidación se produce en el electrodo de cinc o electrodo negativo de donde salen los iones Zn²⁺ hacia la disolución. El de reducción tiene lugar en el electrodo de cobre o electrodo positivo en donde los iones Cu²⁺ se reducen a cobre metálico depositándose sobre la superficie del electrodo. Estos dos procesos electroquímicos mantienen la polaridad eléctrica de los electrodos respectivos; la existencia de una diferencia de potencial constante entre ellos puede comprobarse intercalando un voltímetro.
Autor: Ricardo Santiago Netto. Argentina
¿Que postula la ley de Faraday?