Electrólisis: Corriente eléctrica y movimiento de iones
Si se coloca un par de electrodos en una cuba que contenga una disolución de un electrólito y se conecta una fuente de corriente contínua y un galvanómetro entre ellos, se observará en el galvanómetro la circulación de la corriente eléctrica (figura 1).
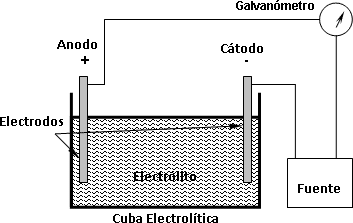
Figura 1: Esquema de una cuba electrolítica y sus componentes
Corriente eléctrica y movimiento de iones
Los iones positivos de la disolución se mueven hacia el electrodo negativo cátodo y los iones negativos hacia el positivo ánodo. Al llegar a los electrodos, los iones pueden ganar o perder electrones y transformarse en átomos neutros o moléculas. La acción de una corriente sobre un electrólito puede entenderse con un ejemplo sencillo de la figura 2.
Reacciones de electrodo
¿Qué le sucede a un ion en movimiento cuando llega al electrodo que lo atrae? Se considerará al cloruro de sodio fundido, un sistema qué sólo contiene dos tipos de iones y no otras partículas. Se utilizarán electrodos inertes que no reaccionan químicamente con los iones sodio y cloruro. Los iones de sodio (+) o cationes, son atraídos hacia el electrodo negativo (cátodo). El cátodo se hace negativo por la acción de un generador el cual, le bombea electrones.
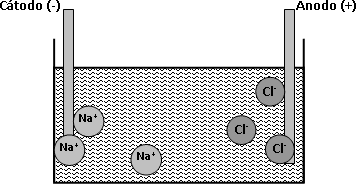
Figura 2: Ejemplo de la electrólisis del cloruro de sodio
Los electrones del cátodo están en un estado de elevada energía potencial. El ion sodio tiene carga positiva, esto significa que atrae electrones y que un electrón de un átomo de sodio tendría una menor energía potencial que un electrón del cátodo. Por lo tanto los electrones del cátodo se desplazan hacia el catión, por diferencia de energía potencial. En el cátodo los iones de sodio se convierten en átomos de sodio por adición de un electrón. Este es un cambio químico y puede representarse con la siguiente ecuación:
Na⁺ + e ⟶ Na°
Adviértase que este cambio químico representa una ganancia de electrones, por lo tanto, el sodio se redujo y pasó a estado metálico. El cambio químicos que siempre ocurre en el cátodo es de reducción.
Ahora se considerará lo que sucede en el ánodo. El ánodo es positivo ya que el generador bombea electrones fuera de él y además atrae iones cloruro (-) o aniones. En el ánodo los electrones poseen baja energía potencial. En cambio los electrones externos del ion cloruro se encuentran en un estado de potencial elevado. Cuando los iones cloruro llegan al ánodo le proporcionan electrones a este. Los electrones pasan de un estado de energía potencial elevada a uno de baja energía potencial. El cambio ocurrido en el ánodo puede representarse con otra ecuación:
2·Cl⁻ ⟶ Cl₂ + 2·e⁻
Los iones cloruro pierden electrones transformándose en átomos de cloro, los cuales a su vez forman moléculas de cloro gaseoso. La reacción anódica siempre es de oxidación.
Aquí se han mostrado las reacciones de oxidación y reducción por separado pues ocurren en diferentes puntos, sin embargo estos procesos no ocurren independientemente. El generador no produce electrones, sólo los transporta de un lugar a otro, así los electrones que el generador suministra al cátodo, provienen del ánodo. El proceso de reducción no puede ocurrir sin que al mismo tiempo se realice el de oxidación. La función del generador es elevar la energía potencial de los electrones del cátodo.
Estas reacciones de electrodo se llaman semireacciones, y la reacción global de la electrólisis del cloruro de sodio es:
2·Na⁺ + 2·Cl⁻ ⟶ 2·Na° + Cl₂
La naturaleza de las reacciones del electrodo depende de la diferencia de potencial o voltaje aplicado.
Autor: Ricardo Santiago Netto. Argentina
¿Qué ocurre en el ánodo y el cátodo? ¿Cómo funciona la electrolisis?