Problema nº 2 de electrólisis. Leyes de Faraday, volumen de un gas que se deposita en un electrodo - TP02
Enunciado del ejercicio nº 2
¿Qué volumen de O₂ en CNPT se produciría por electrólisis de 10 g de agua? Escriba las reacciones de electrodo.
Desarrollo
Datos:
m O₂ = 10 g
F = 96.500 C
ζO₂ = 0,000083 g/C *
Fórmulas:
m = ζ·i·t
q = i·t
p·V = n·R·T
Solución
a) Reacciones en los electrodo.
Semirreacción en el cátodo:
2·H⁺(aq) + 2·e ⟶ H₂(g) (reducción)
Semirreacción en el ánodo:
2·H₂O(aq) - 2·e ⟶ O₂(g) + 4·H+(aq) (oxidación)
Sumamos las semirreacciones anteriores para obtener la reacción total:
2·H₂O(aq) ⟶ 2·H₂(g) + O₂(g)
b)
Una molécula de oxígeno gaseoso intercambia 2 electrones, por lo que requiere 2 Faraday de carga para reducirse.
Una molécula de agua tiene una masa de 18,01534 g, en ella hay 15,9994 g de O₂ que requieren 2 Faraday. Calculamos la carga eléctrica para obtener el oxígeno contenido en 10 g de agua:
![]()
![]()
q = 53.565,46143 C
La ecuación de carga eléctrica es:
q = i·t
La primera ley de Faraday es:
m = ζ·i·t
Reemplazamos:
m = 0,000083 g/C·53565,46143 C
m = 4,445933299 g
Con la masa de oxígeno obtenido calculamos el volumen en CNPT, considerando que los cálculos realizados hasta aquí corresponden a 25 °C y 1 atmósfera de presión.
Para hallar el volumen debemos emplear la ecuación de estado de los gases.
p·V = n·R·T
Donde:
R es la constante de los gases.
![]()
T se mide en grados kelvin.
Convertimos las unidades:
T = 25 °C + 273 °C
T = 298 K
Calculamos n:
![]()
![]()
n = 0,138940626 moles de O₂
Despejamos V:
![]()
Reemplazamos por los datos y calculamos:
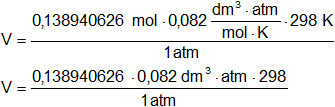
V = 3,395153134 dm³
Respuesta b): el volumen de oxígeno obtenido es 3,395 dm³.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular el volumen de un gas que se deposita en un electrodo