Problema nº 3 de estequiometria de las reacciones químicas, reactivos y productos - TP06
Enunciado del ejercicio nº 3
Calcular el peso de cal viva (CaO) que puede prepararse calentando 91 kg de caliza con una pureza del 95 % de CaCO₃.
Desarrollo
Datos:
mCaCO₃ = 91 kg = 91.000 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
CaCO₃ ⟶ CaO + CO₂
Calculamos el mol de cada compuesto que interviene en la reacción:
CaCO₃: 40,08 g + 12,01115 g + 3·15,9994 g = 100,08935 g
CaO: 40,08 g + 15,9994 g = 56,0794 g
CO₂: 12,01115 g + 2·15,9994 g = 44,00995 g
Calculamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
![]()
Calculamos la masa de óxido de calcio necesaria:
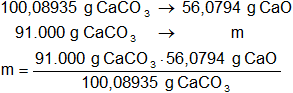
x = 50.986,697 g de CaO (100 % de pureza)
x = 0,95·50.986,697 g de CaO (95 % de pureza)
x = 48.437,363 g de CaO (95 % de pureza)
Resultado: la masa de óxido de calcio que se puede obtener es 48,44 kg.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular las masas de las sustancias reaccionantes y de los productos de reacción