Problema nº 5 de estequiometria de las reacciones químicas, reactivos y productos - TP06
Enunciado del ejercicio nº 5
Se hace saltar una chispa en una mezcla que contiene 100 g de H₂ y 100 g de O₂ de modo que se forma agua según la reacción:
2·H₂ + O₂ ⟶ 2·H₂O
¿Qué masa de agua se forma?
Desarrollo
Datos:
mH₂ = 100 g
mO₂ = 100 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·H₂ + O₂ ⟶ 2·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
H₂: 2·1,00797 g = 2,01594 g
O₂: 2·15,9994 g = 31,9988 g
H₂O: 2·1,00797 g + 15,9994 g = 18,01534 g
Calculamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
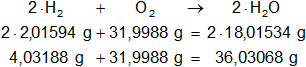
De las masas calculadas estequiométricamente observamos que el hidrógeno y el oxígeno se relacionan aproximadamente 4/32 ≅ 1/8.
Por lo tanto, siguiendo la ley de conservación de las masas, hay un reactivo limitante.
Calculamos la masa de agua que se formará con 100 g de oxígeno:
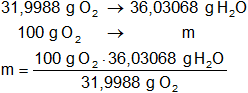
x = 112,6000975 g de H₂O
Resultado: la masa de agua que se forma es 112,6 g.
El oxígeno es el reactivo limitante.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular las masas de las sustancias reaccionantes y de los productos de reacción