Espectros ópticos
Cuando se hace pasar la radiación emitida por un cuerpo caliente a través de un prisma óptico, se descompone en distintas radiaciones electromagnéticas dependiendo de su distinta longitud de onda (los distintos colores de la luz visible, radiaciones infrarrojas y ultravioleta) dando lugar a un espectro óptico. Todas las radiaciones obtenidas impresionan las películas fotográficas y así pueden ser registradas.

Cada cuerpo caliente da origen a un espectro diferente ya que esta depende de la propia naturaleza del foco.
Los espectros pueden ser de emisión y absorción. A su vez ambos se clasifican en continuos y discontinuos:
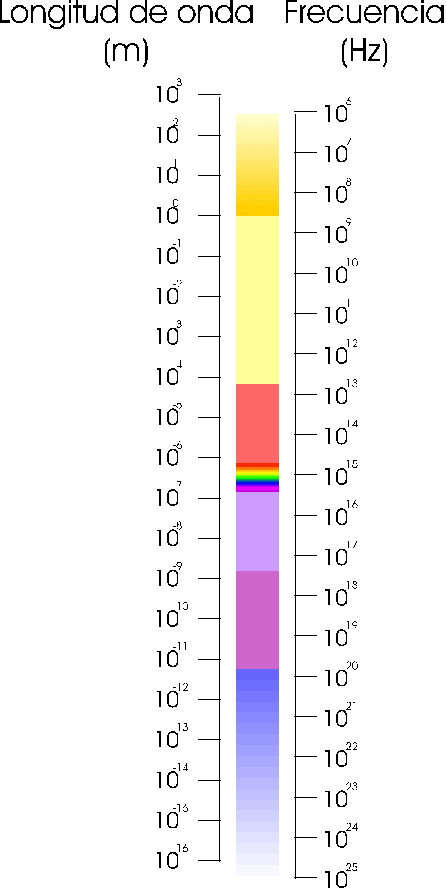
Espectro electromagnético
- Espectros de emisión: Son aquellos que se obtienen al descomponer las radiaciones emitidas por un cuerpo previamente excitado
- Los espectros de emisión continuos se obtienen al pasar las radiaciones de cualquier sólido incandescente por un prisma. Todos los sólidos a la misma temperatura producen espectros de emisión iguales
![]()
Espectro continuo de la luz blanca
Los espectros de emisión discontinuos se obtienen al pasar la luz de vapor o gas excitado. Las radiaciones emitidas son características de los átomos excitados.
![]()
Espectro de emisión de vapores de litio
- Espectros de absorción: Son los espectros resultantes de intercalar una determinada sustancia entre una fuente de luz y un prisma
- Los espectros de absorción continuos se obtienen al intercalar el sólido entre el foco de radiación y el prisma. Así, por ejemplo, si intercalamos un vidrio de color azul quedan absorbidas todas las radiaciones menos el azul
- Los espectros de absorción discontinuos se producen al intercalar vapor o gas entre la fuente de radiación y el prisma. Se observan bandas o rayas situadas a la misma longitud de onda que los espectros de emisión de esos vapores o gases
![]()
Espectro de absorción discontinuo
Se cumple así la llamada ley de Kirchhoff, que dice:
Todo cuerpo absorbe las mismas radiaciones que es capaz de emitir.
Teoría de Planck
En 1.900 emitió una hipótesis que interpretaba los resultados experimentales satisfactoriamente como los cuerpos captaban o emitían energía.
Según Max Karl Ernst Ludwig Planck, la energía emitida o captada por un cuerpo en forma de radiación electromagnética es siempre un múltiplo de la constante h, llamada posteriormente constante de Planck por la frecuencia v de la radiación.
ε = n·h·v
h = 6,62·10⁻³⁴ J·s, constante de Planck
v = frecuencia de la radiación
A h·v le llamó cuanto de energía. Que un cuanto sea más energético que otro dependerá de su frecuencia.
Modelo atómico de Bohr
Para salvar los inconvenientes del modelo anterior, Niels Henrik David Bohr estableció una serie de postulados (basados en la teoría de Planck y los datos experimentales de los espectros) que constituyen el modelo atómico de Bohr:
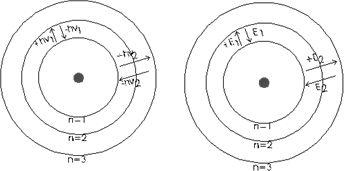
Representación del modelo atómico de Bohr
Admitió que hay ciertas órbitas estables en las cuales los electrones pueden girar alrededor del núcleo sin radiar energía. Deduce que sólo son posibles aquellas órbitas en las que el momento angular del electrón es múltiplo entero de h/2·π
![]()
- Introduce un número "n", llamado número cuántico principal, que da nombre a las distintas órbitas del átomo
El electrón, cuando emite energía cae de una órbita a otra más próxima al núcleo. Lo contrario ocurre si capta energía.
Como según la teoría electromagnética una carga acelerada tiene que irradiar energía, no puede haber ningún orbital permanente. Por eso, Neils Bohr argumentaba que no se podía perder energía continuamente, sino en cuantos (de acuerdo con la teoría de Planck) equivalentes a la diferencia de energía entre las órbitas posibles.
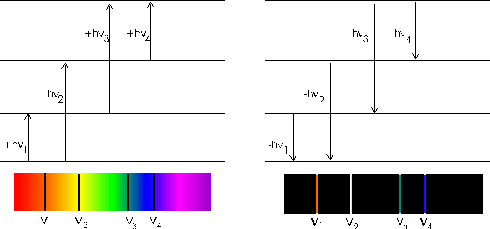
Representación en el espectro de del salto de electrones entre orbitales
Cuando a un átomo se le suministra energía y los electrones saltan a niveles más energéticos, como todo sistema tiende a tener la menor energía posible, el átomo es inestable y los electrones desplazados vuelven a ocupar en un tiempo brevísimo (del orden de 10⁻⁸) el lugar que dejasen vacío de menor energía, llamados niveles energéticos fundamentales.
Así pues, ya tenemos una explicación de los espectros atómicos con el modelo de Bohr. Cuando un átomo es excitado por alguna energía exterior, algún electrón absorbe dicha energía pasando de un nivel energético fundamental a niveles de energía superior. Como, según Planck, la absorción de energía está cuantizada, la diferencia de energía entre ambos niveles será hv. El electrón absorbe solo una radiación de frecuencia v determinada mayor cuanto mayor sea el "salto" del electrón.
Así, en el espectro de absorción aparecerá una banda contínua con algunas rayas negras que corresponderán a aquellas frecuencias determinadas que los electrones han captado para pasar de un nivel a otro más energético.
Como el átomo excitado es inestable, en un tiempo brevísimo el electrón desplazado volverá al nivel energético fundamental, emitiendo una energía de la misma frecuencia hv que absorbió anteriormente.
Así, el espectro de emisión del elemento estará formado por líneas definidas, situadas en la misma longitud de onda que el espectro de emisión, separadas por zonas oscuras.
Ello explica por que los espectros de los vapores o gases (en los que nos encontramos los átomos o moléculas aislados sin interaccionar entre sí) son discontinuos.
Es un hecho experimental que cada elemento químico tiene su espectro atómico característico.
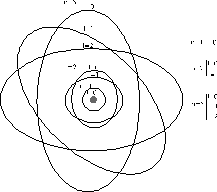
Representación del salto de electrones en el modelo atómico de Bohr
Fue a partir de las series del hidrógeno, de las frecuencias de las distintas radiaciones emitidas, de donde Neils Bohr dedujo los niveles de energía correspondientes a las órbitas permitidas. Sin embargo, al aplicar esta distribución de los niveles energéticos a otros elementos no se correspondían esos cálculos teóricos con los resultados experimentales de los espectros, que eran muchos más complejos. Incluso el mismo átomo de Hidrógeno con espectroscopios más precisos producía líneas que con el modelo de Bohr no se podía explicar.
Corrección de Sommerfeld
Al perfeccionarse los espectroscopios (aparatos que muestran los espectros) se observó que las líneas del espectro del hidrógeno eran en realidad varias líneas muy juntas. Y lo que Neils Bohr creyó que eran estados únicos de energía eran varios estados muy próximos entre sí.
Arnold Sommerfeld lo interpretó diciendo que las órbitas podían ser elípticas. Para ello introdujo un nuevo número cuántico l, también llamado número azimutal, que puede valer:
L = 0, 1, …, (n - 1)
Este número nombra a cada uno de los niveles de energía posibles para cada valor de n. Con Sommerfeld, para determinar la posición del electrón en el átomo de hidrógeno hay que dar 2 números cuánticos l y m.
Efecto Zeeman
Cuando se obtiene el espectro del átomo de hidrógeno mientras el gas está dentro de un campo magnético se observa un desdoblamiento de las líneas que analizó Sommerfeld. Cada una de estas líneas se desdoblaba en varias. Este fenómeno desaparecía al desaparecer el campo magnético por lo que no se debe a que existan nuevos estados distintos de energía del electrón, sino que está provocado por la interacción del campo magnético externo y el campo magnético que crea el electrón al girar en su órbita.
Este problema se solucionó pensando que para algunas de las órbitas de Sommerfeld existen varias orientaciones posibles en el espacio que interaccionan de forma distinta con el campo magnético externo. Para ello se creo un nuevo número cuántico magnético, que vale para cada valor de l:
M = -l, …, -1, 0, 1, …, +l
Para determinar pues la posición del electrón en el átomo de hidrógeno hay que dar 3 números cuánticos: n, l, m.
Efecto Zeeman anómalo
Al perfeccionar los espectroscopios y analizar los espectros obtenidos por el efecto Zeeman, se comprobó que cada línea era en realidad dos líneas muy juntas. Esto se llamó efecto Zeeman anómalo, y si desaparecía el campo magnético externo también desaparecía este efecto.
Se explicó admitiendo que el electrón puede girar sobre sí mismo y hay dos posibles giros, que interaccionaban de forma distinta con el campo magnético externo y que por eso cada línea se desdoblaba en 2. Se creó un nuevo número cuántico s, o número de spin (giro), al que se le dio 2 valores, uno para cada sentido:
S = +½, -½
Para describir la posición de un electrón se necesitan 4 números cuánticos: (n, l, m, s).
Sin embargo, todo lo anterior sólo era útil para el átomo de hidrógeno, pues su aplicación en la descripción de otros átomos fracasó.
Autor: José González.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).