Ley de Boyle y Mariotte
La ley de Boyle y Mariotte enuncia que, "a temperatura constante, el producto del volumen de un gas por la presión que el mismo soporta es una constante".
p·V = p'·V' = p"·V" = constante.
Esta ley, por cumplirse a temperatura constante es una ley isotérmica.
La ley de Boyle y Mariotte es válida solo para gases ideales donde no cambia la masa del gas.
Consideremos el siguiente ejemplo, un cilindro que contiene gas y un émbolo que va a ejercer presión:
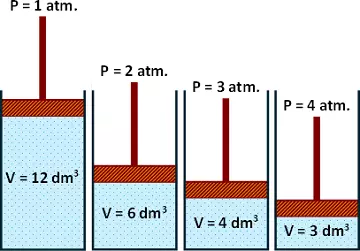
A partir del esquema generamos la siguiente tabla de valores:
| A | B | C | D | E | |
|---|---|---|---|---|---|
| p | 1 atm | 2 atm | 3 atm | 4 atm | 6 atm |
| V | 12 dm³ | 6 dm³ | 4 dm³ | 3 dm³ | 2 dm³ |
A continuación construimos la gráfica:
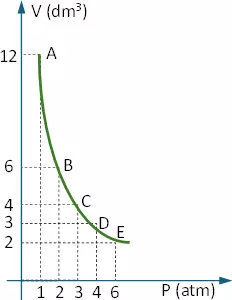
Este gráfico permite hallar rápidamente qué volumen ocupa el gas a una presión dada.
Ejemplo:
Un recipiente contiene 10 dm³ de gas a 5 bar. ¿Cuál será su volumen a 12 bar si la temperatura permaneció constante?
Aplicamos la ley de Boyle Mariotte:
p·V = p'·V'
Despejamos V':
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado:
V' = 4,17 dm³
Conceptos
La presión ejercida por un gas depende:
- Del número de partículas de gas por unidad de volumen.
- De la energía cinética media de las partículas de gas.
Un gas ideal es un gas imaginario cuyas partículas no tienen diámetro ni se atraen mutuamente.
El volumen de un gas no solo depende del número de partículas sino también de la temperatura y de la presión.
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué enuncia la ley de Boyle y Mariotte?