Ley de las presiones parciales de Dalton
La presión total en un recipiente que contiene una mezcla de gases es la suma de las presiones de los gases contenidos en el recipiente.
pT = ∑pg
La presión total de la mezcla de gases se calcula, simplemente, sumando las presiones parciales de todos los gases que la componen.
Es decir, cada gas ejerce la misma presión como si estuviera solo a la misma temperatura, se entiende que el volumen del recipiente es constante.
Cuando un gas forma parte de una mezcla, la presión que ejerce es su presión parcial. Todos los gases de un recipiente están a la misma temperatura y ocupan el mismo volumen. Por lo tanto, la diferencia de sus presiones parciales sólo se debe a la diferencia en el número de moléculas presentes.
Por ejemplo, supongamos que tenemos un litro de oxígeno y un litro de nitrógeno a temperatura ambiente y a la presión atmosférica y se mezclan. En seguida, el volumen de la mezcla se ajusta a un litro sin cambiar la temperatura. La presión ejercida por esta mezcla será de dos atmósferas. Sin embargo, la presión ejercida por el oxígeno seguirá siendo de una atmósfera al igual que la ejercida por el nitrógeno.
El aire es un ejemplo de esta mezcla, contiene nitrógeno, oxígeno, argón, dióxido de carbono y otros gases en pequeñas cantidades. A nivel del mar, la suma de sus presiones parciales es de 1 atmósfera o 760 mm Hg.
Si el 78 % de las moléculas del aire, en condiciones normales, son de nitrógeno, el 78 % de la presión del aire se debe al nitrógeno. En esas condiciones, la presión parcial del nitrógeno del aire es:
pN = 0,78·760 mm Hg = 593 mm Hg
Ejemplo:
Se tiene un recipiente de 2 dm³ a 0 °C y 800 mm Hg de presión con la siguiente mezcla de gases:
Cl₂ = 74,31 %
H₂ = 1,58 %
O₂ = 16,77 %
N₂ = 7,34 %
Calcular la presión parcial de cada gas.
Solución:
pT = pCl + pH + pO + pN
pT = 800 mm Hg
Presión parcial de cloro
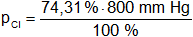
pCl = 594,47 mm Hg
Presión parcial de hidrógeno
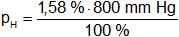
pH = 12,68 mm Hg
Presión parcial de oxígeno
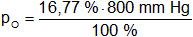
pO = 134,14 mm Hg
Presión parcial de nitrógeno
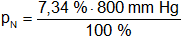
pN = 58,72 mm Hg
Sumamos las preciones parciales para verificar:
pT = pCl + pH + pO + pN
pT = 594,47 mm Hg + 12,68 mm Hg + 134,14 mm Hg + 58,72 mm Hg
pT = 800 mm Hg ∎
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué enuncia la ley de las presiones parciales?