Problema nº 10 de gases ideales, efusión y peso molecular - TP14
Enunciado del ejercicio nº 10
La presión en un recipiente que contenía oxígeno puro disminuyó de 2.000 mm Hg a 1.500 mm Hg en 47 minutos cuando el oxígeno escapaba por un orificio pequeño. Cuando el mismo recipiente se llenó con otro gas, la presión disminuyó de 2.000 mm Hg a 1.500 mm Hg en 74 minutos. ¿Cuál es el peso molecular del segundo gas?
Desarrollo
Datos:
ΔP₁ = Δp₂ = 2.000 mm Hg a 1.500 mm Hg
tO₂ = 47 minutos
tₓ = 74 minutos
M₁ = 31,9988 g/mol
Fórmulas:
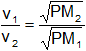
Solución
Desconocemos las velocidades, pero podemos hallar la relación entre ellas:
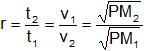
Reemplazamos por los datos y calculamos:
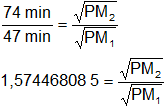
Despejamos PM₂:
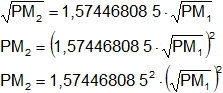
PM₂ = 2,478949751·PM₁
PM₂ = 2,478949751·31,9988 g/mol
PM₂ = 79,32341729 g/mol
Resultado, el peso molecular del segundo gas es:
PM₂ = 79,32 g/mol
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP14
- | Siguiente ›
Ejemplo de cómo determinar el peso molecular de un gas por efusión