Número de Avogadro
El número de Avogadro expresa la cantidad de moléculas que hay en la molécula gramo (mol) de una sustancia o el número de átomos que hay en un átomo gramo de esa sustancia.
N = 6,02·10²³ (602.214.076.000.000.000.000.000)
Cantidad de moléculas
| 32 g de oxígeno | ↘ | Hay 6,02·10²³ moléculas |
| 2,016 g de hidrógeno | ⟶ | |
| 28 g de nitrógeno | ↗ |
Cantidad de átomos
| 16 g de oxígeno | ↘ | Hay 6,02·10²³ átomos |
| 1,008 g de hidrógeno | ⟶ | |
| 14 g de nitrógeno | ↗ |
Volumen molar
| 22,4 dm³ de oxígeno | ↘ | Hay 6,02·10²³ moléculas |
| 22,4 dm³ de hidrógeno | ⟶ | |
| 22,4 dm³ de nitrógeno | ↗ |
Ejemplo:
Calcular la cantidad de moléculas y átomos que forman 2,5 moles de agua.
Solución:
Calculamos la cantidad de moléculas contenidas en un mol de agua, urilizamos "regla de tres simple" y el número de Avogadro.
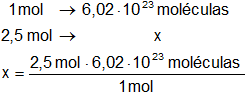
Moléculas = 1,505·10²⁴
Para el cálculo de la cantidad de átomos no especifica la especie, por lo tanto, tomaremos la cantidad de átomos total que, en el caso del agua, es 3.
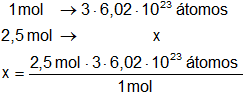
Átomos = 4,515·10²⁴
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué es el número de Avogadro?