Ley de Dalton (gravimétrica o ponderal)
La ley de Dalton dice que "cuando dos elementos se combinan para formar varios compuestos diferentes las masas de uno de ellos combinadas con una misma masa del otro guardan entre sí una relación que se puede expresar por números enteros generalmente pequeños".
Ejemplo:
El análisis de 1 g de distintos compuestos de azufre y de cloro dio los siguientes resultados:
Compuesto 1: S = 0,4749 g y Cl = 0,5251 g
Compuesto 2: S = 0,3112 g y Cl = 0,6888 g
Compuesto 3: S = 0,1843 g y Cl = 0,8157 g
Aplicando la ley de Proust hallamos la masa de azufre que se combina con 1 g de cloro en cada compuesto:
Compuesto 1
![]()
Compuesto 2
![]()
Compuesto 3
![]()
Comparamos los tres resultados dividiendo por el menor de ellos tenemos:
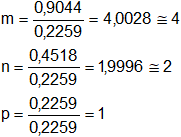
En este caso m, n y p son respectivamente 4; 2 y 1 (números enteros y pequeños)
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué dice la ley de las proporciones múltiples?