Química de los compuestos del carbono (segunda parte)
Aplicación: determinación de la fórmula empírica de un alcohol
Ejemplo: Se desea determinar la fórmula empírica de un alcohol, para lo cual se queman 92,0 gramos del alcohol problema y se obtienen como productos de la reacción de combustión 176,0 g de dióxido de carbono y 108,0 g de agua.
a) Identificar el alcohol de que se trata.
b) Escribir la reacción de combustión ajustada.
Desarrollo
Datos:
n° de gramos CO₂ = 176,0 g
n° de gramos H₂O = 108,0 g
n° de gramos alcohol = 92,0 g
Solución
Un alcohol está constituido por átomos de H, C y O de modo que el cálculo de la proporción en la que tales átomos intervienen permitirá determinar los subíndices característicos de la fórmula empírica. En lo que sigue se procederá a calcular el número de moles de cada elemento cuya proporción equivale a la del número de átomos correspondientes.
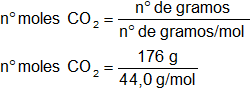
n° de moles CO₂ = 4,0 moles
Pues:
M(CO₂) = M(C) + 2·M(O)
M(CO₂) = 1,02 + 2·16,0
M(CO₂) = 44,0 g/mol
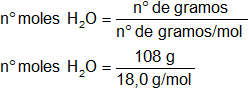
n° de moles H₂O = 6,0 moles
Pues:
M(H₂O) = 2·M(H) + M(O)
M(H₂O) = 2·1,0 + 16,0
M(H₂O) = 18,0 g/mol
Como el CO₂ y el H₂O son los dos únicos productos de la combustión, todo el C y el H de tales productos procederá del alcohol de modo que los 92,0 g de alcohol contendrán 4,0 moles de átomos de carbono y 12,0 moles de átomos de hidrógeno, o lo que es lo mismo, 4,0·12,0 = 48,0 gramos de carbono y
12,0·1,0 = 12,0 gramos de hidrógeno, siendo los 32,0 gramos restantes de oxígeno (12,0 + 48,0 + 32 = 92,0), que equivalen a 32,0/16,0 = 2,0 moles de átomos de este elemento.
La proporción en número de moles es por tanto:
4 de C ; 12 de H ; 2 de O
Proporción que, según el concepto de mol, equivale a la del número de átomos correspondientes y que se traduce en una fórmula química del tipo C₄H₁₂O₂, es decir, C₂H₆O. Se trata, por tanto, del alcohol etílico o etanol, cuya fórmula semidesarrollada es CH₃—CH₂OH.
La reacción de combustión ajustada de este alcohol vendrá dada por la ecuación:
C₂H₆O + 3·O₂ 2·CO₂ + 3·H₂O
Los 92,0 g de alcohol se completan hasta los 176,0 + 108,0 = 284,0 g de productos con el oxígeno atmosférico, que aparece como reactivo en el primer miembro de la ecuación química.
Isomería
El término isomería procede del griego (isos = igual; meros = parte) y se refiere a la propiedad que presentan algunos compuestos, particularmente los orgánicos, de poseer la misma fórmula molecular, pero características diferentes. Los compuestos isómeros poseen la misma composición en lo que se refiere al tipo de elementos y a su proporción; dicho de otro modo, tienen los mismos átomos componentes y en igual número, pero organizados de diferente manera; son por tanto compuestos distintos.
Isomerías planas
El butano, por ejemplo, es un hidrocarburo saturado cuya fórmula empírica o molecular es C₄H₁₀. Pero a esa misma fórmula empírica se ajustan dos compuestos diferentes que pueden distinguirse, desde el punto de vista de la organización de sus átomos, escribiendo su fórmula desarrollada o incluso semidesarrollada:
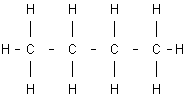
Fórmula del n-butano | 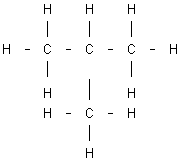
Fórmula del isobutano |
Para diferenciarlos se utilizan los nombres de n-butano (butano normal) e isobutano (isómero del butano). Este tipo de isomería, que afecta a la disposición de los diferentes eslabones de la cadena hidrocarbonada, recibe el nombre de isomería de cadena.
Otro tipo de isomería denominada isomería de posición, es la que presentan los compuestos que teniendo la misma fórmula molecular e idéntica función química (alcohol, ácido, aldehído, etc.), se diferencian en la posición que el grupo funcional correspondiente ocupa en la molécula. Así, por ejemplo, el grupo alcohol - OH en el propanol puede situarse unido, bien a un átomo de carbono extremo, o bien al átomo de carbono central. En ambos casos la fórmula molecular es C₃H₈O, pero se trata de dos compuestos diferentes:
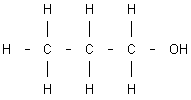
Fórmula del n-propanol | 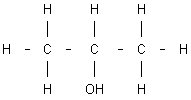
Fórmula del iso-propanol |
Un tercer tipo de isomería fácil de reconocer es la que afecta a la función (isomería de función). La presentan los compuestos con igual fórmula molecular, pero diferente función química. Tal es el caso, por ejemplo, de los aldehídos y las cetonas y, particularmente, del propanol frente a la propanona:
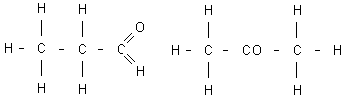
Fórmulas del propanol (C₃H₆O) y propanona (C₃H₆O)
Estereoisomerías
Cualquiera de las isomerías anteriormente consideradas constituye una isomería plana. Se les otorga este nombre porque son tan fáciles de reconocer que basta disponer de la fórmula plana de los compuestos para averiguar si son o no isómeros. No obstante, la naturaleza presenta otros tipos de isómeros más difíciles de identificar; para conseguirlo es preciso efectuar una representación de la molécula en el espacio y analizar la orientación relativa de sus átomos o grupos de átomos; por tal motivo este tipo de isomería recibe el nombre de isomería del espacio o estereoisomería. La forma más simple de estereoisomería es la llamada isomería geométrica o isomería cis-trans.
Este tipo de isomería se presenta asociada a rotación impedida de la molécula sobre un enlace carbono-carbono. Tal es el caso de aquellos hidrocarburos no saturados en los que la presencia de un doble enlace elimina la posibilidad de rotación en torno a él. En la figura adjunta se representa un esquema genérico de isómeros cis-trans; a y b representan dos átomos o grupos de átomos diferentes.
El plano vertical que contiene al doble enlace divide en dos (1 y 2) al plano de la molécula. En el primer caso (isómero-cis) los grupos a se hallan situados al mismo lado (2) del doble enlace, mientras que en el segundo (isómero-trans) los grupos iguales entre sí se hallan situados a uno y otro lado del plano definido por el doble enlace. Ambos compuestos, cualesquiera que sean a y b, aun teniendo la misma composición química, difieren en sus propiedades; son por tanto isómeros (estereoisómeros).
El tipo de isomería más especial es la llamada isomería óptica. Los isómeros ópticos poseen las mismas propiedades químicas y físicas salvo en lo que respecta a su comportamiento frente a la luz, de ahí su nombre. La isomería óptica tiene su origen en una orientación espacial diferente de los átomos o grupos de átomos que constituyen los isómeros. Se trata, por tanto, de una estereoisomería. Se presenta cuando en la molécula existe un átomo de carbono asimétrico, es decir, un átomo cuyos cuatro enlaces se unen a átomos o grupos atómicos diferentes. En tal caso son posibles dos distribuciones de los diferentes átomos en torno al carbono asimétrico, que guardan entre sí la misma relación que un objeto y su imagen en el espejo, o lo que es lo mismo, que la mano izquierda respecto de la mano derecha. Ambas conformaciones moleculares son simétricas pero no idénticas, esto es, no superponibles, del mismo modo que tampoco lo son las dos manos de una misma persona.
La importancia de la química orgánica
A pesar de su aparición tardía en la historia de la química, la química de los compuestos del carbono es en la actualidad la rama de las ciencias químicas que crece con mayor rapidez. La variedad de productos derivados del carbono puede resultar prácticamente ilimitada debido a las propiedades singulares de dicho átomo y, por tanto, constituye una fuente potencial de nuevos materiales con propiedades especiales, de medicamentos y productos sanitarios, de colorantes, de combustibles, etc. Algunos de estos ejemplos son considerados a continuación.
La materia viviente es, en parte, materia constituida por derivados del carbono. Las transformaciones que sufren los seres vivos, y que observamos a simple vista, se corresponden, desde un punto de vista submicroscópico o molecular, con cambios o reacciones químicas de las sustancias biológicas. Azúcares, grasas, proteínas, hormonas, ácidos nucleicos, son algunos ejemplos de sustancias, todas ellas compuestos del carbono, de cuya síntesis y degradación en el interior de los organismos vivos se ocupa la bioquímica.
Medicamentos
El mundo de los medicamentos ha constituido en el pasado y constituye en la actualidad una parte importante de la investigación y el desarrollo de productos derivados del carbono. Su importancia en orden a mejorar la esperanza de vida de los seres humanos y sus condiciones sanitarias hace de este área del conocimiento científico una herramienta imprescindible para la medicina. Pero, ¿por qué los medicamentos son, por lo general, compuestos orgánicos? ¿Cuál es el origen de este hecho?
Los fármacos actúan en el organismo a nivel molecular y es precisamente el acoplamiento entre la molécula del fármaco y el receptor biológico, es decir, el sitio de la célula o del microorganismo sobre el cual aquél actúa, el último responsable de su acción curativa. Pero para que ese acoplamiento sea posible ambos agentes, fármaco y receptor, tienen que presentar una cierta complementariedad tal y como sucede con una cerradura y su correspondiente llave. Los receptores biológicos suelen ser moléculas de gran tamaño y por este motivo son las cadenas carbonadas de los compuestos orgánicos las que pueden poseer una estructura geométrica que mejor se adapte a la porción clave del receptor; tal hecho, junto con la presencia de grupos funcionales con acciones químicas definidas, son responsables de la abundancia de sustancias orgánicas entre los productos farmacéuticos.
Polímeros orgánicos
Los polímeros orgánicos son compuestos formados por la unión de dos o más unidades moleculares carbonadas idénticas que reciben el nombre de monómeros. La unión de dos monómeros da lugar a un dímero, la de tres a un trímero, etc.
Los polímeros pueden llegar a contener cientos o incluso miles de monómeros, constituyendo moléculas gigantes o macromoléculas.
Existen en la naturaleza diferentes sustancias que desde un punto de vista molecular son polímeros, tales como el caucho o las proteínas; pero en el terreno de las aplicaciones los más importantes son los polímeros artificiales. Su síntesis en los laboratorios de química orgánica ha dado lugar a la producción de diferentes generaciones de nuevos materiales que conocemos bajo el nombre genérico de plásticos. La sustitución de átomos de hidrógeno de su cadena hidrocarbonada por otros átomos o grupos atómicos ha diversificado las propiedades de los plásticos; la investigación en el terreno de los polímeros artificiales ha dado como resultado su amplia implantación en nuestra sociedad, sustituyendo a materiales tradicionales en una amplia gama que va desde las fibras textiles a los sólidos resistentes.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›
¿Qué es y que estudia la química orgánica? ¿Qué son los hidrocarburos y cómo se clasifican?