Problema nº 10 de propiedades coligativas, presión osmótica de una disolución - TP06
Enunciado del ejercicio nº 10
¿Cuál es la presión osmótica a 0 °C de una disolución (sc) acuosa que contiene 46,0 g de glicerina (C₃H₈O₃) por litro?
Desarrollo
Datos:
m = 46 g de soluto
V = 1.000 ml de disolución
t° = 0 °C
R = 0,08205 atm·dm³/K·mol
Fórmulas:
π·V = n·R·T
Solución
Calculamos el mol de la sacarosa:
C₃H₈O₃: 3·12 g + 8·1 g + 3·16 g = 92 g
Mol = 92 g
Convertimos las unidades:
V = 1.000 ml = 1 dm³
T = 273 + 0
T = 273 K
Aplicamos la ley de Van't Hoff:
π·V = n·R·T
![]()
Reemplazamos n:
![]()
Despejamos π:
![]()
Reemplazamos por los valores y calculamos:
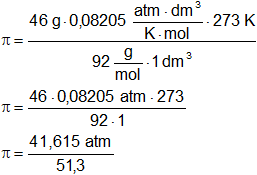
π = 11,193 atm
Resultado, la presión osmótica de la disolución es:
π = 11,2 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la presión osmótica de una disolución