Problema nº 10 de estequiometría de las disoluciones, molaridad y masa - TP07
Enunciado del ejercicio nº 10
¿Cuál era el contenido de torio en una muestra que necesitó 35 ml de H₂C₂O₄ 0,02 M para precipitar Th(C₂O₄)₂?
Desarrollo
Datos:
V₁ = 35 ml
M₁ = 0,02 M
Solución
Calculamos el mol del ácido etanodioico:
H₂C₂O₄: 2·1,00797 g + 2·12,01115 g + 4·15,9994 g = 90,03584 g
La molaridad indica el número de moles de soluto (st) disueltos por cada litro de disolución.
Determinamos la masa de H₂C₂O₄ en 1 litro de disolución 0,02 M:
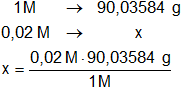
x = 1,8007168 g/l de ácido etanodioico
Hallamos la masa de H₂C₂O₄ en 0,035 litros (35 ml) de disolución 0,02 M:
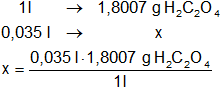
x = 0,063025088 g de ácido etanodioico
Dada la fórmula del oxalato de torio, Th(C₂O₄)₂, intervienen dos moles de ácido etanodioico o ácido oxálico para su formación.
Th(C₂O₄)₂ ⟶ Th⁴⁺ + 2·C₂O₄²⁻
Luego:
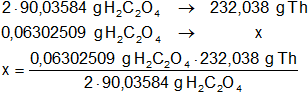
m = 0,0812133 g de Th
Resultado, la masa de torio de la muestra es:
m = 0,081 g de Th = 81 mg de Th
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la masa dada la molaridad en la neutralización de soluciones