Problema nº 5 de estequiometría de las disoluciones, molaridad y molalidad - TP09
Enunciado del ejercicio nº 5
Calcular la molaridad y la molalidad de una disolución (sc) de ácido sulfúrico de peso específico relativo 1,198 que contiene 27 % de ácido en peso.
Desarrollo
Datos:
Csc = 27 % p/p
ρᵣ = 1,198
Fórmulas:
![]()
Solución
Aplicamos la fórmula de peso específico relativo y la desarrollamos:
![]()
La densidad es:
![]()
Reemplazamos:
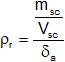
δₐ = 1
Despejamos msc:
msc = Vsc·ρᵣ·δₐ
Tomamos Vsc = 1.000 ml
Reemplazamos por los valores y calculamos:
msc = 1.000 ml·1,198·1 g/ml
msc = 1.198 g
Esto nos dice que cada litro de disolución pesa 1.198 g.
La concentración está expresada en % p/p, por tanto:
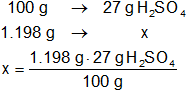
x = 323,46 g H₂SO₄
Calculamos la masa del mol de ácido sulfúrico:
H₂SO₄: 2·1,00797 g + 32,064 g + 4·15,9994 g = 98,07754 g
a)
Calculamos la molaridad:
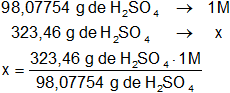
x = 3,298002784 M
Resultado a), la molaridad de la disolución es:
C = 3,3 M
b)
Calculamos la molalidad:
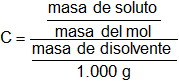
Reemplazamos por los valores y calculamos:

C = 3,771128575 m
Resultado b), la molalidad de la disolución es:
C = 3,77 m
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la molaridad y la molalidad de una disolución dado el peso específico