Problema nº 10 de estequiometría de las disoluciones, concentración peso en peso y normalidad - TP09
Enunciado del ejercicio nº 10
Calcular el volumen de HCl concentrado (peso específico relativo = 1,19; 38 % de HCl en peso) que se necesitan para preparar 18 litros de disolución 1/50 N
Desarrollo
Datos:
C₁sc = 38 % p/p
C₂sc = 1/50 N
V₂sc = 18 l
ρᵣ = 1,19
Fórmulas:
![]()
Solución
Calculamos el peso molecular del ácido clorhídrico:
HCl: 1,00797 g + 35,453 g = 36,46097 g
Calculamos el equivalente gramo del ácido clorhídrico:
![]()
Eg = 36,46097 g
Una disolución 1 N de HCl contiene 36,46097 g por litro.
Calculamos la masa de HCl para una disolución 1/50 N = 0,02 N:
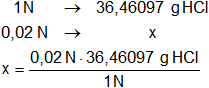
x = 0,7292194 g de HCl
Luego, calculamos la cantidad de HCl concentrado al 38 % que contendrá 1 litro de la masa hallada:
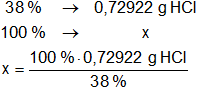
x = 1,918998421 g de HCl
Determinamos la masa de ácido clorhídrico concentrado para 18 litros:
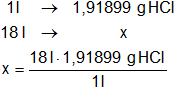
x = 34,54197158 g de ácido clorhídrico concentrado en 18 litros de disolución.
El enunciado nos pide el volumen, aplicamos la fórmula de peso específico relativo y la desarrollamos:
![]()
La densidad es:
![]()
Reemplazamos:
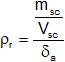
δₐ = 1
Despejamos Vsc:
![]()
Reemplazamos por los valores y calculamos:
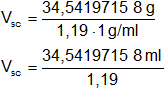
Vsc = 29,02686687 ml
Resultado, el volumen de HCl concentrado necesario para preparar la disolución es:
Vsc = 29 ml
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular el volumen de una disolución dado el peso específico