Problema nº 4 de fórmula mínima y molecular - TP07
Enunciado del ejercicio nº 4
La composición centesimal de una sustancia es C = 93,76 %; H = 6,24 %. En 0,16 moles de esa sustancia hay 0,965·10²⁴ átomos de carbono. Hallar la fórmula mínima y la molecular.
Desarrollo
Datos:
nC = 0,965·10²⁴ (9,65·10²³) átomos en 0,16 moles
H = 6,24 %
C = 93,76 %
Masa atómica H = 1
Masa atómica C = 12
Solución
La masa de la sustancia equivale al 100 % por tanto:
H = 6,24 % ≡ 6,24 g
C = 93,76 % ≡ 93,76 g
Calculamos el número de átomos gramos de cada componente que hay en los 100 g de sustancia:
![]()
![]()
![]()
![]()
El número de átomos gramos de cada elemento debe ser entero, dividimos por el menor valor:
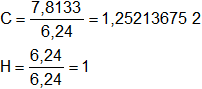
Aún no logramos que el número de átomos gramos de cada elemento sea entero, por tanteo multiplicamos por 4:
H = 1·4 = 4
C = 1,252136752·4 = 5,008547009 ≅ 5
Respuesta, la fórmula mínima es: C₅H₄
El enunciado indica que en 0,16 moles del compuesto hay 9,65·10²³ átomos de C. Calculamos para 1 mol:
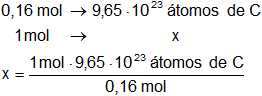
x = 6,03·10²⁴ átomos de C
En un átomo gramo habrá:

x = 10,019 átomos gramo de C
Los átomos gramos son el doble que en la fórmula mínima, por tanto, para calcular la fórmula molecular multiplicamos los subíndices por 2:
Respuesta, la fórmula molecular es: C₁₀H₈
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplos de cómo calcular la fórmula mínima y la fórmula molecular