Metabolismo de lípidos
Los lípidos son moléculas con grandes diferencias estructurales de unas a otras. Tienen características comunes de insolubilidad en agua. Tienen 2 funciones preferentes:
- Componentes esenciales de membrana (fosfolípidos)
- Depósito de energía más importante de la célula (triglicéridos). Los triacilgliceroles son los principales sustratos energéticos, almacenados en el citosol de las células del tejido adiposo. El hígado es muy importante en el metabolismo de lípidos y síntesis de ácidos grasos. Cuando sobra energía sintetiza lípidos. Los ácidos grasos suelen tener un número par de átomos de C. Se diferencian en la longitud de la cadena y el número de insaturaciones
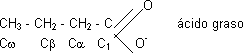
En la síntesis de una grasa se une 1 glicerol con 3 ácidos grasos para dar triacilglicerol:
| CH₂O HCOH CH₂O Glicerol | Esterificación ⟶ | CH₂O—CH₂—CH₂—COO⁻ HCO—CH₂—CH₂—COO⁻ CH₂O—CH₂—CH₂—COO⁻ Triacilglicerol |
La ruptura es por hidrólisis mediante una lipasa. Los ácidos grasos se degradarán dando C₂ que es el acetil-CoA que entrará en el C.A.C. dando CO₂. El glicerol mediante glicolisis da piruvato y éste acetil-CoA que sigue el mismo proceso. El glicerol viene de la glucosa por medio de la ruta glicolítica. Para sintetizar grasas hacen falta hidratos de carbono porque la glucosa es necesaria para formar C₃. También a partir de acetil-CoA.
Las grasas son un buen almacén de energía, mejor que el glucógeno porque los componentes de los triacilgliceroles están muy reducidos, se obtiene más energía al oxidarlos. Las grasas son insolubles en agua y el glucógeno es soluble, por lo que puede estar en forma hidratada. Esto es importante a la hora de almacenar porque con el mismo pero del glucógeno se obtiene menos energía porque está menos reducido y parte es agua. Obtenemos 6 veces más energía de la grasa.
Fuentes de triacilglicéridos
Dieta
El 90 % de los lípidos son triacilgliceroles (TG), otros fosfolípidos (PL), otros colesterol (C) y ésteres del colesterol (EC). Hay que hidrolizarlos antes de que entren en el intestino. Si las grasas son insolubles y la enzima es soluble hay un problema. Para que la enzima pueda actuar han de estar en forma de emulsión, lo que se consigue con sales biliares y movimientos peristálticos del intestino. El enzima que hidroliza los lípidos es una lipasa del intestino, segregada por el páncreas en forma de precursor inactivo llamado prolipasa. El precursor se activa en presencia de una proteína producida en la pared intestinal llamada colipasa. La lipasa digiere las grasas hidrolizando el enlace éster y liberando los ácidos grasos. Normalmente libera los de los extremos dando 2.monoacilglicerol. Una vez dentro del intestino se vuelven a unir formando el triacilglicerol. Se han de romper para poder pasar. Una vez resintetizado va por el torrente sanguíneo a todo el organismo. Como la sangre es acuosa al sintetizarlos en la mucosa se unen a lípidos polares (PL, E, EC) y con proteínas (lipoproteínas). Las lipoproteínas hacen que sean solubles. Hay varios tipos según su composición, aunque la estructura es muy parecida en todas. La de la mucosa intestinal es la quilomicrón. Porcentaje de TG muy alto, hasta el 95 %, con lo que son muy poco densas. Pasan a la sangre transportando TG por el sistema linfático. Una vez en la sangre son usados por 2 tipos de células, las hepáticas y los adipocitos. En la célula sólo entran los ácidos grasos, por lo que una la lipoproteínlipasa los separa. Los ácidos grasos pueden ir libres por la sangre unidos a la proteína albúmina de la sangre (seroalbúmina).
Tejido adiposo
En el tejido adiposo los ácidos grasos se pueden almacenar en forma de TG. Estos se hidrolizan y sintetizan continuamente, por lo que cuando falta glucosa los ácidos grasos salen a la sangre y se usan como sustrato energético. La lipasa está controlada hormonalmente, existe en dos formas según esté fosforilada (activa) o no por la proteínquinasa A. Hormonas como el glucagón producen un aumento del nivel de AMP que activa PKA que a su vez activa a la lipasa. Si el nivel de glucosa sube se secreta insulina que bloquea la lipasa.
Células hepáticas
Los ácidos grasos se almacenan en forma de TG que se sintetizan e hidrolizan continuamente. El hígado es un sitio muy importante se síntesis de ácidos grasos a partir de otras moléculas. A partir de sustratos sobrantes sintetiza ácidos grasos que por esterificación dan TG, que son enviados al tejido adiposo unidas a proteínas en lipoproteínas distintas a los quilomicrones. Estas son sintetizadas por el hígado, tienen distinta proporción de componentes. Tienen muy poca densidad, las VLDL (Very low Density Level). Su función es transportar los ácidos grasos sintetizados por exceso de hidratos de carbono.
Para recogerlos el adipocito se necesita un enzima igual al anterior que los hidrolice. La lipoproteína suelta parte de los TG y pasa a LDL, más densa y especialmente rica en colesterol, que manda a tejidos periféricos. La HDL es más densa, el colesterol en esta forma no es malo porque se transporta de vuelta al hígado para ser metabolizado. El tejido adiposo no puede degradar el glicerol porque no puede fosforilarlo. El hígado sí puede (glicolisis, gluconeogénesis).
Degradación de ácidos grasos
Primera etapa: activación
La degradación de ácidos grasos ocurre en la mitocondria y la lipasa está en el citosol. Para poder entrar en la mitocondria ha de activarse. En el citosol se une al CoA. Este es un punto de control importante. Se activa por medio del ATP. La reacción transcurre en 2 etapas:
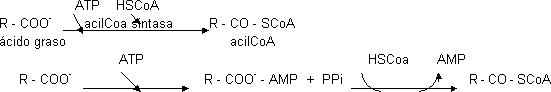
| Se activa uniéndose al nucleótido. La parte del nucleótido forma un derivado activado | Se cede el grupo al CoA. El PPi se hidroliza con pirofosfatasa, lo que desplaza la reacción a la derecha |
Esta es una reacción previa al metabolismo de ácidos grasos. Entra 1 ATP y sale 1 AMP. Siempre que esto ocurre es como si se gastaran 2 ATP.
Segunda etapa: transporte dentro de la mitocondria
El CoA no tiene transportador. El grupo acilo entra transfiriéndose a una molécula de la membrana de la mitocondria que la transporta (translocasa). El único modo de que entre es por medio de la carnitina que recoge el ácido graso y lo mete dentro en forma de acilcarnitina (ambos).
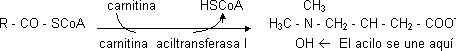
La transferasa da el acilo y deja el CoA en el citosol. Está localizada en la membrana interna de la mitocondria mirando al citosol. Dentro de la mitocondria hay otro enzima igual que cumple la función inversa (carnitina aciltransferasa II). La CAT1 es el punto de control más importante.
Tercera etapa: β-oxidación
Se oxida el Cᵦ del ácido graso separando C₂ en forma de acetil-CoA. Los 4 enzimas de la mitocondria no están dispuestos formando un complejo. Consta de 4 etapas:
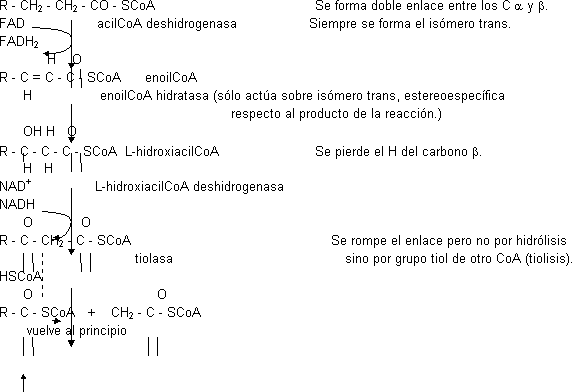
Balance: si el ácido graso tiene número par de átomos de C sólo quedará acetil-CoA. Si hubiera sido el palmitato (16 C):
Palmítico ⟶ 8 acetil-CoA, 7 NADH y 7 ATP
Degradación del acetil-CoA en el ciclo del ácido cítrico
Se darán 8 vueltas del C.A.C. ⟶ 16 CO₂, 24 NADH, 8 FADH₂ y 8 GTP.
O lo que es lo mismo, a 12 ATP por vuelta, 96 ATP.
Los NADH y FADH₂ de la β-oxidación dan 35 ATP más.
Total ATP: 131 ATP de la degradación 1 molécula de palmítico.
Balance de la oxidación del palmitato: 16 CO₂ y 131 ATP de los que se deben restar 2 porque se forma palmitoilCoA con gasto de ATP.
Balance neto: 129 ATP.
16 C + 129 ADP + 129 Pi ⟶ 16·CO₂ + 129 ATP
La degradación sólo ocurre en presencia de O₂ porque es necesario para regenerar los coenzimas. Todo el metabolismo dentro de la mitocondria es aerobio.
Como cada vez que pasan 2 e⁻ por la cadena de transporte electrónico se forma H₂O, de lo que resultan 146 moléculas de H₂O. Las grasa son fuente de energía y de agua.
Un ácido graso está más reducido que un hidrato de carbono, por lo que se obtiene más energía:
Ácido graso: 129 ATP/16 C = 8,1 ATP/C
Glucosa: 36 ATP/6 C = 6 ATP/C
Las reacciones de la β-oxidación son iguales a las del C.A.C. Las 4 etapas de la β-oxidación son iguales a las de regeneración del oxalacetato:
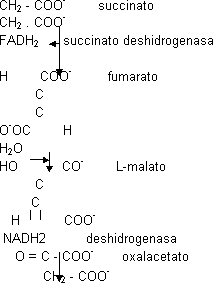
Si el ácido graso tiene un número impar de átomos de C el residuo C₃ que queda al final (propionil-CoA) se metaboliza incorporándose al C.A.C.:
Propionil CoA + CO₂ ⟶ C₄ (succinil CoA)
Biosíntesis de ácidos grasos saturados
Se da en el citosol. Preferentemente en células hepáticas, adipocitos y glándulas mamarias. En la síntesis se produce reducción, hará falta aportar e⁻. Los dadores no son NADH y FADH₂ sino el NADPH (provienente de la ruta de los fosfatos de pentosa). Todos los intermediarios (la cadena que se sintetiza) están unidos al grupo SH de la ACP (Acil Carrier Protein). El grupo prostético se llama fosfopanteteína y es igual a un trozo del CoA. Se unen moléculas C₂ sucesivamente. Si el ácido graso es impar el primer C₂ es el propionil-CoA. Primero se une un acetil-CoA y luego es preciso que el acetil-CoA esté activado por medio de una carboxilación que da como resultado malonil-CoA. El CO₂ solo tiene una función catalítica, favorece la condensación y luego se separa.
Síntesis
El acetil-CoA se forma a partir de piruvato por la piruvato deshidrogenasa dentro de la mitocondria. También puede venir de la β-oxidación, para que salga al citosol se condensa con oxalacetato para dar citrato, Si hay mucha energía el C.A.C. está inhibido. El citrato por medio de una transportador sale al citosol y se rompe liberando los C₂
![]()
Como el OAA no tiene transportador ha de pasar a malato (igual que en el C.A.C). El malato se transforma en piruvato:
![]()
El piruvato ya puede volver dentro y dar OAA otra vez. Para sintetizar acetil-CoA ha de sobrar energía y haber hidratos de carbono. Para que pueda salir el citrato ha de estar parado el C.A.C., es decir, sobrar energía y haber hidratos de carbono (para que hayan piruvato y oxalacetato). El OAA siempre está en niveles bajos en la mitocondria. Al sobrar hidratos de carbono se sintetiza ácidos grasos.
Activación del acetil-CoA
![]()
Esta es la etapa limitante de la velocidad y el punto de control más importante. Todas las carboxilasas tienen biotina. La reacción ocurre en 2 etapas. La biotina, que está unida covalentemente al enzima, se une al CO₂ para que sea más fácil transferirlo. Se forma carboxibiotina. Se agrega el acetil-CoA y se transforma en malonil-CoA.
En "escherichia coli" se han hallado 3 cadenas distintas con funciones específicas:
- Cadena portadora de biotina (unida a Lys)
- Cadena que carboxila la biotina (carboxilasa) catalizando la reacción
- Cadena que transfiere el grupo al acetil-CoA (transcarboxilasa)
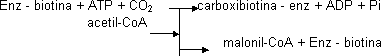
El citrato es un modulador positivo de la acetil-CoA carboxilasa. Si hay citrato hay acetil-CoA y la enzima más importante de la ruta está en forma activa: activa el punto de control y saca el acetil-CoA del citosol.
Condensación
Participan 7 enzimas. En procariotas hay 7 cadenas distintas pero en eucariotas forman un complejo enzimático llamado sistema ácido graso sintasa. El complejo ofrece la ventaja de la rapidez. Varias actividades catalíticas residen en la misma cadena, son multifuncionales. En la parte central del complejo está la ACP con un largo brazo al que se unen los intermediarios por medio del grupo SH. También participa otro SH de una Cys.
El primer C₂ es el acetil-CoA y luego todos son malonil-CoA. Si el ácido graso es impar el primero es el propionil-CoA. En el proceso de carga de la enzima se transfieren al SH de la ACP por medio de la ACP acetil/malonil transferasa. El primer C₂ es transferido a la Cys guardando el malonil-CoA en la ACP. Se produce una reacción de condensación entre acetilo y malonilo facilitada por la descarboxilación, que dirige la reacción. El enzima condensante es la oxoacil ACP sintasa y es donde está localizada la Cys. Se forma acetoacil.

Para reducir el carbonilo hay 3 etapas inversas de la β-oxidación:
Reducción formándose grupo hidroxilo en el Cᵦ
![]()
Deshidratación:
![]()
Reducción:
![]()
Ahora se une con otro malonil-CoA y vuelve a empezar.
HS - Cys
CH₃—CH₂—CH₂—CO—CH₂—CO—S—ACP
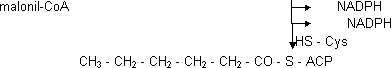
El último C es el que forma el grupo carbonilo. Cuando el resto es de 16 carbonos cesa la actividad de la ácido graso sintasa porque no puede cargar con una cadena tan larga y poner 2 más. Se hidroliza y se separa el palmitato. Si hay insaturaciones se ponen luego y si la cadena es más larga se hace en otro sitio. Algunos insaturados son esenciales y no se pueden sintetizar, se han de ingerir.
Balance de la síntesis del palmitato:
1 acetil-CoA+7·malonil-CoA(CO₂+acilo) + 14·NADPH ⟶ palmitato + 8·HSCoA + 7·CO₂ + 14·NADP⁺
Para 7 malonil-CoA: 7 CO₂ + 7 acetil-CoA + 7 ATP ⟶ 7 malonil-CoA
8 acetil-CoA + 14 NADPH + 7 ATP ⟶ palmitato + 14 NADP⁺ + 7 ADP + 7 Pi
del ciclo de fosfatos de pentosa.
Destinos de los ácidos grasos
Normalmente no se hallan libres, se incorporan en forma de fosfolípidos de membrana o triacilglicéridos (TG) como depósito de energía. Han de esterificar al glicerol en los dos casos que ha de estar fosforilado (glicerol 3P). El glicerol 3 P viene de:
- PDHA que a su vez viene de la glucosa, se consume 1 NADH actuando la glicerol 3 P deshidrogenasa
- Directamente del glicerol por medio de la glicerol 3P quinasa. Este glicerol viene de las grasa hidrolizadas. Se esterifica con ácidos grasos activados (acil-CoA):
2 acil-CoA pueden esterificar los OH del glicerol 3P:
| ácido graso + HSCoA | ATP ⟶ AMP + PPi | Acil-CoA |
| ⟶ | ||
| Acil-CoA sintasa |
CH₂—O—CO—R₁
CH₂—O—CO—R₂ ← ácido fosfatídico, precursor de fosfolípidos y triacilgliceroles.
CH₂—O—P
Para formar el triacilglicerol se sustituye P por medio de una fosfatasa. Luego se añade acil-CoA para dar TG (CH₂—O—CO—R₃).
Regulación
| Trigliceroles | Lipasa | Ácidos grasos + glicerol |
| ⟶ ← | ||
| Esterificación |
La conversión de TG a ácidos grasos + glicerol ocurre continuamente en el tejido adiposo. Cuando sobra energía se sintetizan TG con ácidos grasos y glicerol. La glucosa aporta el Gd3P necesario, por lo que sólo se esterificará cuando sobren hidratos de carbono. Cuando hay poca glucosa se degradan grasas. La lipasa está regulada por hormonas, cuando está fosforilada es activa. La activación la desencadena el glucagón que a través de la cascada enzimática pone en marcha la PKA que fosforila la lipasa. Cuando la concentración de glucosa es alta se secreta insulina que favorece la esterificación. Se sintetizan ácidos grasos a partir de acetil-CoA y su degradación da la misma molécula. La síntesis a partir de acetil-CoA se da cuando la carga energética es alta y hay hidratos de carbono (para sacar acetil-CoA con OAA). No deben haber ácidos grasos.
Puntos de regulación
- Síntesis: punto de control es la enzima que modifica el acetil-CoA, la acetil-CoA carboxilasa
- Degradación: enzima que activa acetil-CoA para entrar ácidos grasos e mitocondria transfiriéndolos a la carnitina, la carnitina aciltransferasa I
Regulación de la síntesis: acetil-CoA carboxilasa
• Regulada a nivel hormonal por glucagón (inhibe) e insulina (activa)
• Regulado también alostéricamente:
- Modulador +: citrato, que favorece la conformación más activa además de sacar el acetil-CoA
- Modulador -: palmitoil-CoA, que es el producto de la reacción. También la carga energética, concretamente el AMP
• Regulado covalentemente Fosforilada es inactiva. Si la quinasa está favorecida bloquea la síntesis de ácidos grasos y si lo es la fosfatasa activa la enzima. La insulina favorece la fosfatasa y el glucagón la quinasa
• Regulación a largo plazo: la enzima puede variar su concentración, se puede inducir su síntesis. El ayuno prolongado y luego una dieta rica en hidratos de carbono y pobre en grasa aumenta mucho la concentración de la enzima
Regulación de la degradación: carnitina aciltransferasa 1
Es modulador - el malonil-CoA que es el producto de la acetil-CoA carboxilasa. Si sube su concentración es porque sobra energía y hay hidratos de carbono y al estar inhibido la enzima no pueden entrar los acetil-CoA en la mitocondria.
Cuerpos cetónicos.
Acetoacetato: (CH₃)—(CO)—(CH₂)—(COO⁻)
Hidroxibutirato: (CH₃)—(CHOH)—(CH₂)—(COO⁻)
Acetona: (CH₃)—(CO)—(CH₃)
Al degradar ácidos grasos se obtiene acetil-CoA que puede ir al C.A.C. si hace falta energía, pero hace falta OAA. Si faltan hidratos de carbono el acetil-CoA no puede entrar en el C.A.C. porque el OAA forma glucosa. Si no hay hidratos de carbono los niveles de OAA están comprometidos y no podemos degradar acetil-CoA. Cuando se ayuna y en la diabetes (enfermedad en la que no se usan bien los hidratos de carbono y es como si no hubiera glucosa) se degradan muchos ácidos grasos. Aumenta mucho la concentración de acetil-CoA que no puede ir al C.A.C. por lo que forma complejos cetónicos, de los cuales se puede obtener energía.
Formación.
Se forman sobre todo en el hígado dentro de las mitocondrias por condensación:
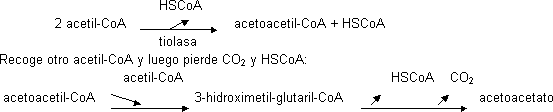
El otro cuerpo cetónico se convierte en hidroxibutirato por medio de una deshidrogenasa y la acetona se obtiene del acetoacetato por medio de una descarboxilación. El acetoacetato se usa convirtiéndolo en acetoacil-CoA recibiendo una molécula de HSCoA del succinil-CoA
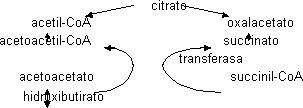
Todos los tejidos menos el hepático puede usar los cuerpos cetónicos como sustrato energético porque tienen la transferasa. Si la concentración de cuerpos cetónicos es muy alta disminuye el pH de la sangre, el enfermo hace olor a acetona y puede llegar al coma diabético. El cerebro puede acostumbrarse a usar cuerpos cetónicos en condiciones de ayuno prolongado, lo que evita tener que degradar proteínas.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).