Equilibrio químico en las reacciones
Equilibrio químico
El concepto de equilibrio químico
La idea de reacción química lleva a veces a suponer que el proceso progresa de los reactivos hacia los productos, y que se detiene cuando se agota el reactivo que se encuentra en menor proporción. Este tipo de reacciones se denominan irreversibles. Sin embargo, con mayor frecuencia sucede que, a medida que los productos van haciendo su aparición en la reacción, tanto mayor es su capacidad para reaccionar entre sí regenerando de nuevo los reactivos. Cuando esto es posible en una reacción química, se dice que es reversible y se representa mediante una doble flecha, indicando así que la reacción puede llevarse a efecto tanto en un sentido como en el inverso:
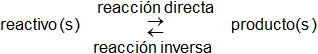
Cada proceso posee una velocidad propia que va variando con el tiempo. Así, en los comienzos, la velocidad de la reacción directa es mucho mayor que la de la reacción inversa, debido a la diferencia de concentraciones entre reactivos y productos; pero a medida que estos últimos se van formando los reactivos van desapareciendo, con lo cual ambas velocidades se aproximan hasta hacerse iguales. A partir de tal instante sucede como si la reacción estuviera detenida, pues las proporciones de reactivos y productos se mantienen constantes. Se dice entonces que se ha alcanzado el equilibrio químico.
El equilibrio químico tiene un carácter dinámico, pues no implica que la reacción se paralice en ambos sentidos como podría pensarse, sino que, en cada unidad de tiempo, se forman y desaparecen el mismo número de moléculas de cualquiera de las sustancias que intervienen en el proceso. Si algunos de los productos pueden desprenderse y abandonar el sistema, se rompe el equilibrio y la reacción se verifica sólo en un sentido, hasta que los reactivos se hayan transformado totalmente.
Por ejemplo, la reacción de oxidación del hierro por vapor de agua a alta temperatura, es reversible cuando se lleva a cabo en un recipiente cerrado:
3·Fe + 4·H₂O ⇌ Fe₃O₄ + 4·H₂
Pero debido a que el hidrógeno es un gas más ligero que el aire, si se abre el recipiente, lo abandonará, con lo cual ya no será posible el proceso inverso y el equilibrio quedará definitivamente roto.
La reacción de formación o síntesis de yoduro de hidrógeno (HI) a partir de sus elementos:
H₂ + I₂ ⇌ 2·HI
Constituye otro ejemplo de reacción reversible. Para estudiarla en el laboratorio se emplean recipientes cerrados de modo que la cantidad total de materia no varíe. Cuidadosas medidas experimentales han permitido calcular las velocidades de las reacciones directa e inversa y su variación con el tiempo. La figura adjunta representa los resultados obtenidos. La velocidad del proceso directo:
H₂ + I₂ ⟶ 2·HI es importante al principio (pendiente pronunciada), mientras que la del proceso inverso: 2·HI ⟶ H₂ + I₂ es casi nula. Conforme el tiempo avanza, la primera va disminuyendo y la segunda aumentando. A partir de un cierto instante ambas coinciden, lo que indica que entonces se ha alcanzado el equilibrio químico.
El principio de Le Châtelier
Existe un principio muy general que determina las posibilidades de variación de los equilibrios químicos. Fue propuesto a finales del siglo pasado por el químico francés Henri Louis Le Châtelier (1.850 - 1.936), por lo que se conoce como principio de Le Châtelier. Se puede enunciar en los siguientes términos:
«Cuando sobre un sistema químico en equilibrio se ejerce una acción exterior que modifica las condiciones del sistema, el equilibrio se desplaza en el sentido que tienda a contrarrestar la perturbación introducida».
He aquí algunos casos concretos de aplicación. Si en un sistema en equilibrio químico se aumenta la concentración de los reactivos, el equilibrio se desplazará hacia la derecha a fin de provocar la transformación de aquéllos en productos y recuperar así la situación inicial.
La ruptura del equilibrio de la reacción:
3·Fe + 4·H₂O ⇌ Fe₃O₄ + 4·H₂
Provocada por la pérdida de H₂, puede explicarse en términos análogos, ya que al disminuir la concentración de H₂ la reacción se desplaza hacia la derecha para producir más hidrógeno, oponiéndose, de este modo, a dicha perturbación.
Una modificación de la temperatura del sistema en equilibrio puede producir igualmente un desplazamiento del mismo en un sentido o en otro. Así, por ejemplo, la reacción:
N₂O₄ + calor ⇌ 2·NO₂
Es endotérmica, por lo que un aumento de la temperatura desplazará el equilibrio en el sentido de la reacción directa, pues es en el que absorbe calor. La reacción inversa se verá favorecida por un enfriamiento, pues en este sentido se produce calor.
También los efectos de variaciones de presión, cuando el sistema posee componentes gaseosos, repercuten por análogas razones sobre el equilibrio. Así, por ejemplo, en la síntesis del amoníaco:
N₂(g) + 3·H₂(g) ⇌ 2·NH₃(g)
Un aumento de presión desplazará el equilibrio hacia la derecha, ya que el número de moléculas en el segundo miembro es inferior y, por tanto, ejercerán una presión menor sobre el recipiente.
La ley del equilibrio químico
El principio de Le Châtelier permite predecir en qué manera se desplazará el equilibrio químico de una reacción reversible, pero no en qué medida. Una descripción cuantitativa del equilibrio fue efectuada por primera vez en 1.870 por los químicos noruegos Cato Maximilian Guldberg (1.836 - 1.902) y Peter Waage (1.833 - 1.900), que la expresaron en forma de ley. Así, para una reacción genérica del tipo:
a·A + b·B ⇌ c·C + d·D
La ley de Guldberg y Waage se expresa matemáticamente en la forma:
![]() (a temperatura constante)
(a temperatura constante)
En la cual los coeficientes estequiométricos a, b, c y d que se obtienen tras ajustar la reacción, aparecen como exponentes de las concentraciones de reactivos y productos; K toma, para cada reacción, un valor constante y característico que sólo depende de la temperatura y que se denomina constante de equilibrio.
La ley de Guldberg y Waage se conoce también como Ley de acción de masas (L.A.M.) debido a que, en el enunciado original, sus autores aludieron a conceptos tales como «fuerzas de acción» y «masas activas». Aunque el descubrimiento de esta ley fue el resultado de análisis de datos experimentales, algunos años más tarde pudo ser explicada teóricamente a partir de las leyes de la termodinámica.
La Ley de acción de masas permite hacer cálculos y predicciones sobre el equilibrio. Así, el efecto de la concentración puede explicarse como sigue: si en un sistema en equilibrio se aumenta la concentración de un reactivo, [A] por ejemplo, la reacción ha de desplazarse hacia la derecha en el sentido de formación de los productos para que el cociente representado por K se mantenga constante.
Aplicación de la ley de acción de masas (I)
La reacción:
2·NO(g) + O₂(g) ⇌ 2·NO₂(g)
Presenta una constante de equilibrio K = 6,45·10⁵ (a 500 K de temperatura). Determinar cuál ha de ser la concentración de oxígeno para que se mantenga el equilibrio en un sistema en el que las concentraciones de NO y NO₂ son iguales.
De acuerdo con la ley de acción de masas:
![]()
y dado que en el sistema considerado [NO₂] = [NO], resulta:
![]()
Es decir:
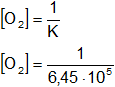
[O₂] = 1,55·10⁻⁶ mol/l
Aplicación de la ley de acción de masas (II)
La constante de equilibrio, a 600 K, de la reacción de descomposición del amoníaco:
NH₃(g) ⇌ ½·N₂(g) + (3/2)·H₂ (g)
Vale K = 0,395. Si en un recipiente de 1,00 l de capacidad y a 600 K se introducen 2,65 g de NH₃ a igual temperatura, calcular cuáles serán las concentraciones en el equilibrio.
La cantidad de NH₃ inicial expresada en moles será:
![]()
n° de moles de NH₃ = 0,156 mol
Pues la masa molecular del amoníaco es:
M(NH₃) = 14,0 + 3·1,0 = 17,0
y, puesto que el volumen del sistema es de un litro, la concentración inicial de NH₃ será:
[NH₃] = 0,156 mol/l
Pero conforme la reacción avance, la concentración irá disminuyendo hasta reducirse al valor de equilibrio. Si suponemos que se han descompuesto x mol/l de NH₃, de acuerdo con la ecuación química de partida, se habrán formado ½·(mol/l de N₂) y (mol/l de N₂)·3/2. Es decir, en el equilibrio:
[NH₃] = (0,156 - x)
[N₂] = ½·x
![]()
Según la ley de acción de masas, se cumplirá la relación:
![]()
y sustituyendo los valores de las concentraciones resulta:
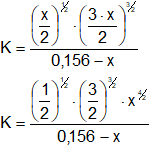
Operando y sustituyendo el valor de K, se tiene:
![]()
Que, reordenada, equivale a la ecuación de segundo grado:
1,30·x² + 0,395·x - 0,0616 = 0
Cuya solución aceptable es:
x = 0,114
Por tanto, las concentraciones de reactivos y productos en el equilibrio serán las siguientes:
[NH₃] = 0,156 - x = 0,156 - 0,114
[NH₃] = 0,042 mol/l
[N₂] = ½·x = ½·0,114
[N₂] = 0,057 mol/l
![]()
[H₂] = 0,171 mol/l
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›
¿Cómo se puede modificar la velocidad en una reacción química?