Primera ley de la termodinámica química
En todo fenómeno químico, la suma algebraica de todos los cambios de energía que se producen durante el fenómeno es igual a cero.
Se observa que esta ley es otra forma de expresar el principio de conservación de la energía: esta no puede ser creada ni destruida.
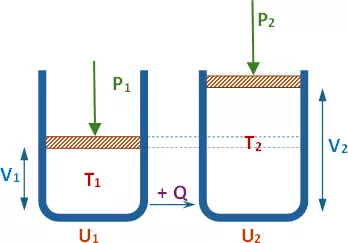
Supongamos una masa gaseosa V₁ encerrada en un cilindro, a una presión P₁ y a una temperatura T₁.
Si llevamos al sistema a una nueva temperatura T₂ el gas se dilatará, realizando un trabajo L, absorbiendo calor, aumentando, por consiguiente, su energía interna, de un valor U₁ a uno nuevo U₂.
Aplicando el principio de conservación de la energía:
Q = L + ΔU
O sea que, el calor entregado al sistema es igual a la suma del trabajo realizado por el sistema y la variación de la energía interna.
Esta es la expresión matemática de la primera ley de la termodinámica que puede enunciarse así:
La primera ley enuncia que, la cantidad de calor (Q) entregada a una masa de gas, es igual al trabajo (L) que realiza ese gas al expandirse, más la variación de su energía interna (ΔU).
Transformación isocora
Se denomina así a una transformación en la que el gas no experimenta cambio de volumen.
Al no haber cambio de volumen, la expresión de la primera ley:
Q = L + ΔU
Se transforma en:
Q = ΔU
Pues el sistema no realiza trabajo.
El calor que se le ha suministrado al sistema, lo ha utilizado éste para aumentar su energía interna.
Transformación adiabática
Se llama así, a toda transformación en la que el sistema no intercambia calor con el medio.
Se puede lograr esta transformación aislando térmicamente al sistema o realizando la transformación rápidamente.
En este caso la expresión de la primera ley:
Q = L + ΔU
Se transforma en:
0 = L + ΔU
| L = -ΔU | o | ΔU = -L |
El significado de estas expresiones es:
El trabajo realizado por o sobre el sistema, se convierte en energía interna, aumentando ésta en el primer caso y disminuyendo en el segundo.
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
Calor, trabajo y energía interna en las transformaciones químicas