Principio de Le Châtelier
El principio de Le Châtelier enuncia: si sobre un sistema en equilibrio una acción exterior produce una modificación, el sistema reaccionará en forma tal de contrarrestar u oponerse a esa modificación.
En todos los casos que siguen el sistema está en equilibrio y se comportará para mantener ese equilibrio.
Los efectos de la variación de la concentración
Para reacciones gaseosas y líquidas.
El aumento de las concentraciones de los reactantes produce un aumento de los productos de reacción para contrarrestar el aumento de las concentraciones de los reactantes.
Por el contrario, un aumento de la concentración de los productos de reacción produce un aumento de la concentración de los reactantes para contrarrestar el aumento de los productos de reacción.
| Aumento de concentración | ⟶ | Aumentan los productos |
| Disminución de concentración | ⟶ | Aumentan los reactantes |
Por ejemplo:
2·HI ⇌ H₂ + I₂
La constante de equilibrio a 425 °C es:
![]()
Supongamos que en el recipiente donde se halla el sistema se aumenta la concentración de hidrógeno en 5 veces su valor.
Como K es constante, mientras no varíe la temperatura, deben modificarse las concentraciones de yodo y de yoduro de hidrógeno. En efecto, aumenta la concentración de HI y disminuye la de yodo. La reacción resultante es:
H₂ + I₂ ⟶ 2·HI
Si, en cambio, se agrega más HI deben aumentar las concentraciones de yodo e hidrógeno para mantener el valor de la constante de equilibrio (K). Ocurre la reacción:
2·HI ⟶ H₂ + I₂
Nótese el cambio de la doble flecha por la flecha simple en las reacciones.
Los efectos de la variación de la presión
Para las reacciones entre gases, el aumento de presión produce un aumento de la concentración del sistema.
Un aumento de la presión es contrarrestado por el sistema formando más productos de reacción para así, disminuir el volumen y, con ello, impedir el aumento de presión que era lo que modificaba el equilibrio del sistema.
Ante una disminución de la presión el sistema reaccionará contrarrestando esa modificación para mantener el equilibrio del sistema. Para ello aumenta el volumen formando más reactantes con lo que logra que la presión aumente.
| Aumento de presión | ⟶ | Aumento de concentración | ⟶ | Aumentan los productos |
| Disminución de presión | ⟶ | Disminución de concentración | ⟶ | Aumentan los reactantes |
Por ejemplo:
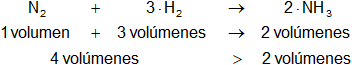
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más amoníaco. La reacción se desplaza hacia la derecha.
![]()
Nótese el cambio de la doble flecha por la flecha simple en las reacciones.
Resumiendo:
Suma de los volúmenes de los reactantes > Suma de los volúmenes de los productos ⟶
Suma de los volúmenes de los reactantes = Suma de los volúmenes de los productos ⇌
Suma de los volúmenes de los reactantes < Suma de los volúmenes de los productos ⟵
Constante de equilibrio de las presiones parciales
En muchos sistemas gaseosos es más conveniente expresar las concentraciones de los gases en función de las presiones parciales. Entonces la constante de equilibrio se designa normalmente por Kₚ.
De la ley de las presiones parciales de Dalton sabemos que:
pT = ∑pg
Donde:
pT: es la presión total de la mezcla gaseosa.
pg: es la presión parcial de cada gas que compone la mezcla.
Se deduce que:
![]()
Donde:
nG: es el número de moles de uno de los gases de la mezcla.
nT: es el número total de moles de los gases de la mezcla.
Dada la reacción reversible:
a·A + b·B ⟶ c·C + d·D
Donde todas las sustancias son gases, la expresión de equilibrio puede escribirse de la siguiente forma:
![]()
El subíndice indica la sustancia y el exponente es el número de moles.
Cuando la reacción, balanceada, no presenta variación en el número total de moles entre reactantes y productos, la constante de equilibrio de las presiones parciales será igual a la constante de equilibrio:
Kₚ = K
Por ejemplo:

En este caso no hay variación entre los volúmenes.
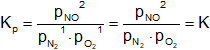
Los efectos de la variación de la temperatura
En un sistema exotérmico un enfriamiento lo hace reaccionar en forma tal de oponerse a ese enfriamiento. Para lograrlo desprende calor y la reacción se acelera.
En un sistema endotérmico un aumento de la temperatura del sistema lo hace reaccionar en forma tal de oponerse a ese aumento. Para ello absorbe calor con lo que aumenta la velocidad de la reacción.
Un aumento de la temperatura retarda los procesos exotérmicos y favorece los procesos endotérmicos.
Una disminución de la temperatura favorece los procesos exotérmicos y retarda los endotérmicos.
| Proceso | Temperatura | Efecto | ΔH |
|---|---|---|---|
| Exotérmico | ↓ | Favorece | - |
| ↑ | Retarda | ||
| Endotérmico | ↓ | Retarda | + |
| ↑ | Favorece |
Por ejemplo:
2·NO ⇌ N₂ + O₂ + calor
Es exotérmica, esto es, se produce con desprendimiento de calor.
Según el principio de Le Châtelier, si se enfría el sistema reaccionará desprendiendo más calor y, formando más nitrógeno y oxígeno.
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Jerome L. Rosenberg. "Teoría y problemas de química general". Libros McGraw-Hill de México S. A. de C. V. México.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
Predicción del desplazamiento de las reacciones en el equilibrio