La energía en las reacciones químicas (segunda parte)
La ley de Hess
Calor de formación y calor de reacción
El calor de formación ΔHf de una sustancia química representa la energía liberada o consumida durante la formación de dicha sustancia, en condiciones normales, a partir de los elementos que la constituyen. Si en tales condiciones se consideran nulos los contenidos energéticos H de los elementos, el calor de formación ΔHf de un compuesto coincide con su contenido energético o entalpía. Si se compara la definición de calor de formación con la de calor de reacción se observa que el calor de formación es un tipo particular de calor de reacción (el correspondiente a reacciones de formación o de síntesis de un compuesto).
La determinación de calores de reacción puede efectuarse de un modo experimental si la reacción correspondiente se lleva a cabo de forma aislada y controlada en el interior de un calorímetro. Sin embargo, en ocasiones, esto no es posible porque tienen lugar varias reacciones simultáneamente, y no una sola. En tales casos es posible determinarlos de una forma indirecta, recurriendo a una propiedad de la entalpía; el hecho de que H sea una función de estado, esto es, que dependa exclusivamente de los estados inicial y final del sistema, permite calcular calores de reacción a partir del conocimiento de procesos intermedios.
Ley de Hess
El calor de formación ΔH₁ del monóxido de carbono, CO:
C (grafito, s) + ½·O₂ (g) ⟶ CO (g) ΔH₁
No puede determinarse directamente porque en las condiciones en que se produce, parte del CO se transforma en CO₂. Sin embargo, sí que es posible medir directamente, con la ayuda del calorímetro, los calores de reacción de los siguientes procesos:
CO (g) + ½·O₂ (g) ⟶ CO₂ (g)
ΔH₂ = 282,6 kJ/mol
C (grafito, s) + O₂ (g) ⟶ CO₂ (g)
ΔH₃ = -392,9 kJ/mol
El conjunto de estas tres reacciones puede escribirse en la forma:
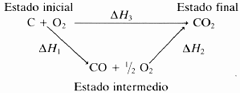
Dado que el efecto térmico de una reacción no depende del camino, sino sólo de los estados inicial y final, se podrá escribir:
ΔH₃ = ΔH₁ + ΔH₂
Por tanto:
ΔH₁ = ΔH₃ - ΔH₂ = -392,9 + 282,6 = 110,3 kJ/mol
Dicho de otro modo cuando una reacción, C + ½·O₂ ⟶ CO, escribirse como la suma algebraica (suma con signos) de otras reacciones:
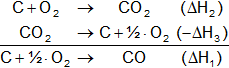
Su calor de reacción es la suma algebraica de los calores de tales reacciones
(ΔH₁ = ΔH₂ - ΔH₃). O en otros términos: el calor de la reacción de un determinado proceso químico es siempre el mismo, cualquiera que sea el camino seguido por la reacción, o sus etapas intermedias.
El contenido de este enunciado recibe el nombre de Ley de Hess. De acuerdo con esa misma ley, los calores de reacción pueden calcularse a partir de los calores de formación de reactivos y productos.
El siguiente diagrama representa los procesos de formación y reacción de reactivos y productos, y sus relaciones en términos energéticos:
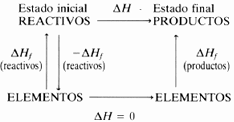
Aplicando la ley de Hess a los dos diferentes caminos que conectan reactivos y productos e igualando ambos términos resulta:
ΔH = -ΔHf (reactivos) + 0 + ΔHf (productos)
Es decir:
ΔH = ΔHf (productos) - ΔHf (reactivos)
Por tanto, el calor de reacción de un proceso químico resulta ser igual a la diferencia entre los calores de formación de los productos y los calores de formación de los reactivos:
ΔH = (suma calores de formación de productos) - (suma calores de formación de reactivos)
Calor de reacción y energía de enlace
La energía de enlace es la cantidad de energía que se libera en la formación de un enlace entre átomos cuando reaccionan en estado gaseoso. Constituye una medida de la fuerza del enlace covalente; así, por ejemplo, a un enlace sencillo carbono-carbono le corresponde una energía de enlace de -83,1 kcal/mol; a uno doble -147 kcal/mol y a uno triple -194 kcal/mol. Desde el punto de vista de la termoquímica, se puede interpretar como la variación de entalpía H correspondiente a una reacción del tipo:
A(g) + B(g) ⟶ A-B(g)
Efectuada en condiciones de 1 atmósfera de presión y 298 K de temperatura, siendo A y B los átomos considerados. La energía de enlace ΔH(A-B) es siempre negativa, pues en la unión disminuye el contenido energético del sistema, haciéndose más estable.
La aplicación de la ley de Hess permite determinar el calor de reacción a partir de las energías de enlace y viceversa. Como ejemplo de la primera posibilidad puede considerarse el cálculo del calor de reacción del proceso:
![]()
En el cual se rompen dos enlaces H—H y un enlace C≡C y aparecen un enlace
C—C y cuatro enlaces H—C nuevos. El balance global de estas operaciones parciales en términos de variación del contenido energético será:
ΔHf = ΔH(C—C) + 4·ΔH(C—H) - [ΔH(C≡C) + 2·ΔH(H—H)]
A partir de las energías de enlace correspondientes, supuestas conocidas, se calcula entonces el calor de reacción.
Como ejemplo de la segunda posibilidad, se presenta el cálculo de la energía de enlace H—Cl a partir del calor de formación ΔHf del HCl y de las energías de los enlaces H—H y Cl—Cl (supuestas conocidas).
La formación del HCl puede efectuarse por los siguientes caminos:
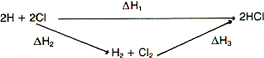
De acuerdo con la ley de Hess:
ΔH₁ = ΔH₂ + ΔH₃
En donde,
ΔH₁ = 2·ΔH·(H—Cl)
ΔH₂ = ΔH·(H—H) + ΔH·(Cl—Cl)
ΔH₃ = 2·ΔHf
Por tanto:
ΔH (H—Cl) = ½·[ΔH (H—H) + ΔH(Cl—Cl) + 2·Δ·Hf]
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›