Problema nº 1 de electrólisis. Leyes de Faraday, masa depositada en un electrodo - TP06
Enunciado del ejercicio nº 1
Se hacen pasar exactamente 0,2 F a través de tres celdas electrolíticas. Una contiene ion plata, la otra contiene ion cinc y la última contiene ion férrico. Suponiendo que la única reacción catódica en cada celda es la de reducción del metal. ¿Cuántos gramos se depositarán de cada metal?
Desarrollo
Datos:
Pa Ag = 107,870 g
Pa Zn = 65,370 g
Pa Fe = 55,847 g
F = 96.500 C (número de Faraday)
Fₓ = 0,2 F
Fórmulas:
![]()
Solución
Recordemos que la masa de los elementos que se depositan en los electrodos es proporcional a los equivalentes químicos con que actúan esos en una reacción dada.
Y que, para depositar un equivalente químico de cualquier elemento se necesita la misma cantidad de electricidad, es decir, 1 Faraday (96.494 C).
Calculamos el equivalente químico de cada ion según su estado de oxidación o valencia con que actúan:
![]()
Reemplazamos por los datos y calculamos:
![]()
EqAg⁺ = 107,870 g
![]()
Reemplazamos por los datos y calculamos:
![]()
EqZn²⁺ = 32,685 g
![]()
Reemplazamos por los datos y calculamos:
![]()
EqFe³⁺ = 18,61566667 g
Finalmente calculamos la masa que se deposita de cada ion:
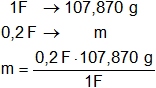
mAg⁺ = 21,56 g (masa que se depositará del ion plata).
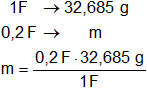
mZn²⁺ = 6,537 g (masa que se depositará del ion cinc).
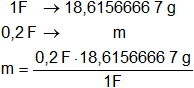
mFe³⁺ = 3,723 g (masa que se depositará del ion férrico).
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la masa de un elemento que se deposita en el electrodo