Problema nº 3, constante de equilibrio químico - TP03
Enunciado del ejercicio nº 3
Un mol de alcohol etílico puro se mezcla con un mol de ácido acético puro a temperatura ambiente. La mezcla, en equilibrio, contiene: ⅔ de mol de etanoato de etilo y ⅔ de mol de agua.
a) Calcular la constante de equilibrio.
b) ¿Cuántos moles de etanoato de etilo hay en el equilibrio cuando se mezclan 3 moles de alcohol etílico con un mol de ácido acético?
Todas las sustancias son líquidas a la temperatura de reacción.
Solución
Expresamos la ecuación equilibrada de la reacción:
CH₃CH₂OH + CH₃COOH ⇌ CH₃COOCH₂CH₃ + H₂O
a)
Planteamos los moles iniciales y en el equilibrio:
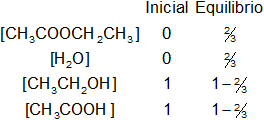
Aplicamos la fórmula de la constante de equilibrio:
![]()
Suponemos que el volumen es constante, por lo tanto, las concentraciones en todos los casos quedan indicados por los valores absolutos de moles de cada sustancia.
Reemplazamos por los datos y calculamos:

Simplificamos:
K = 4
Respuesta a): el valor de la constante de equilibrio K es 4.
b)
x será el número de moles de etanoato de etilo y de agua en el equilibrio.
Si se forman x moles de etanoato de etilo y x moles de agua, desaparecen x moles de alcohol etílico y x moles de ácido acético.
Planteamos los moles iniciales y en el equilibrio:
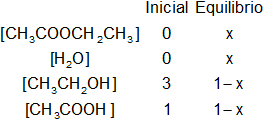
Aplicamos la fórmula de la constante de equilibrio:
![]()
Reemplazamos:
Suponemos que el volumen es constante, por lo tanto, las concentraciones en todos los casos quedan indicados por los valores absolutos de moles de cada sustancia.
![]()
Aplicamos distributiva del producto con respecto a la resta:
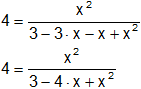
4·(3 - 4·x + x²) = x²
12 - 16·x + 4·x² = x²
Igualamos a cero:
4·x² - x² - 16·x + 12 = 0
3·x² - 16·x + 12 = 0
Aplicamos la ecuación de Báscara o Bhaskara:
![]()
Siendo:
a = 3
b = -16
c = 12
Reemplazamos y resolvemos, obtendremos dos valores:
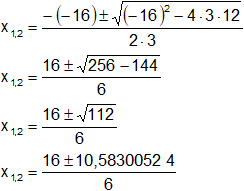
Calculamos los valores de x1,2 por separado según el signo del resultado de la raíz:
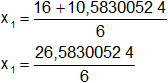
x₁ = 4,430500874 moles de etanoato de etilo (se descarta porque no puede haber más de 1 mol de etanoato de etilo partiendo de 1 mol de ácido acético)

x₂ = 0,902832459 moles de etanoato de etilo
Respuesta b): la cantidad de moles de etanoato de etilo que hay en el equilibrio es 0,9.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la constante de equilibrio