Problema nº 7 de estequiometria de las reacciones químicas, reactivos y productos - TP06
Enunciado del ejercicio nº 7
Considerando la combustión del alcohol amílico, C₅H₁₁OH:
2·C₅H₁₁OH + 15·O₂ ⟶ 10·CO₂ + 12·H₂O
Se pide:
a) ¿Cuántos moles de oxígeno se necesitan para la combustión de un mol de alcohol amílico?
b) ¿Cuántos moles de agua se forman por cada mol de oxígeno consumido?
c) ¿Qué masa de dióxido de carbono se produce por cada mol de alcohol amílico quemado?
d) ¿Qué masa de dióxido de carbono se produce por cada gramo de alcohol amílico quemado?
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·C₅H₁₁OH + 15·O₂ ⟶ 10·CO₂ + 12·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
C₅H₁₁OH: 5·12,01115 g + 15,9994 g + 12·1,00797 g = 88,15079 g
O₂: 2·15,9994 g = 31,9988 g
CO₂: 12,01115 g + 2·15,9994 g = 44,00995 g
H₂O: 2·1,00797 g + 15,9994 g = 18,01534 g
Calculamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
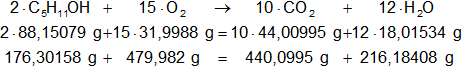
a)
Calculamos los moles de oxígeno necesarios para la combustión completa de un mol de alcohol amílico:
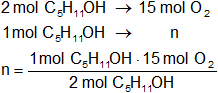
n = 7,5 moles de O₂
Resultado a): los moles de oxígeno que se necesitan para la combustión de un mol de alcohol amílico es 7,5.
b)
Calculamos los moles de agua se forman por cada mol de oxígeno consumido:
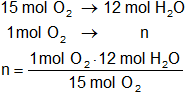
n = 0,8 moles de H₂O
Resultado b): los moles de agua se forman por cada mol de oxígeno consumido es 0,8.
c)
Calculamos la masa de dióxido de carbono que se produce por cada mol de alcohol amílico quemado:
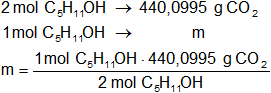
m = 220,04975 g de CO₂
Resultado c): la masa de dióxido de carbono que se produce por cada mol de alcohol amílico quemado es 220 g.
d)
Calculamos la masa de dióxido de carbono que se produce por cada gramo de alcohol amílico quemado:
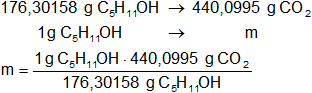
m = 2,496287895 g de CO₂
Resultado c): la masa de dióxido de carbono que se produce por cada gramo de alcohol amílico quemado es 2,5 g.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular las masas de las sustancias reaccionantes y de los productos de reacción