Problema nº 2 de gases ideales, masa de un gas - TP01
Enunciado del ejercicio nº 2
Se tienen 50 dm³ de Cl₂ en CNPT, se desea saber ¿cuántos moles y qué masa de cloro hay?
Desarrollo
Datos:
V = 50 dm³ de Cl₂
Vmol = 22,4 dm³
Solución
Calculamos la masa de un mol de cloro:
Cl₂: 2·35,453 g = 70,906 g
Mediante regla de tres simple calculamos los moles:
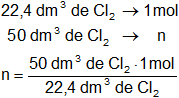
Resultado, los moles de cloro gaseoso en CNPT es:
n = 2,23 moles de Cl₂
Calculamos la masa de cloro:
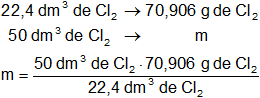
Resultado, la masa de cloro gaseoso en CNPT es:
m = 158,272 g de Cl₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar la masa de un gas