Problema nº 2 de gases ideales, volumen de la masa de un gas - TP02
Enunciado del ejercicio nº 2
¿Qué volumen ocupan a 0 °C y 3 atmósferas de presión 140 g de nitrógeno?
Desarrollo
Datos:
mN = 140 g
t = 0 °C = 273 K
p = 3 atm
R = 0,08205 atm·dm³/K·mol
Fórmulas:
p·V·mol = m·R·T
Solución
Calculamos la masa de un mol de nitrógeno:
Mol de N₂: 2·14,0067 g = 28,0134 g
Aplicamos la fórmula dada despejando "V":
p·V·mol = m·R·T
![]()
Reemplazamos por los valores y calculamos:
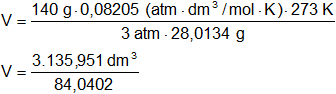
V = 37,314892158 dm³
Resultado, el volumen ocupan 140 g nitrógeno a 0 °C y 3 atmósferas es:
V = 37,3149 dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar el volumen de la masa de un gas