Problema nº 7 de gases ideales, masa de un gas - TP03
Enunciado del ejercicio nº 7
¿Cuánto pesa el aire de una habitación de 8 m × 5 m × 4 m a 27 °C y 720 mm Hg? (δ = 1,293 kg/m³).
Desarrollo
Datos:
p₁ = 720 mm Hg
p₂ = 1 atm
T₁ = 27 °C
T₂ = 237 K
V₁ = 8 m × 5 m × 4 m
δ = 1,293 kg/m³
Fórmulas:
![]()
![]()
Solución
Convertimos las unidades:
![]()
p₁ = 0,9474 atm
T₁ = 27 °C = 300 K
δ = 1,293 kg/m³ = 1,293 g/dm³
Calculamos el volumen de la habitación:
V₁ = 8 m·5 m·4 m
V₁ = 160 m³ = 160.000 dm³
Aplicamos la ecuación general de los gases ideales para determinar el volumen que ocuparía el gas en CNPT, despejamos V₂:
![]()
Reemplazamos por los datos y calculamos:
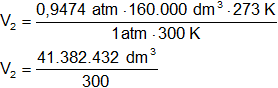
V₂ = 137.941,44 dm³
Con este dato y la densidad calculamos la masa con la primera ecuación:
![]()
m = δ·V₂
m = 1,293 g/dm³·137.941,44 dm³
Resultado, la masa del aire en la habitación es:
m = 178.358,28 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo determinar la masa de un gas