Problema nº 1 de la primera ley de Charles-Gay Lussac de los gases ideales, volumen de un gas - TP16
Enunciado del ejercicio nº 1
Una masa dada de cloro ocupa 38 ml a 20 °C. Determinar su volumen a 45 °C a presión constante.
Desarrollo
Datos:
V₁ = 38 ml
t₁ = 20 °C
t₂ = 45 °C
Presión constante.
Fórmulas:
![]()
Solución
Aplicamos la primera ley de Charles-Gay Lussac de los gases ideales:
![]()
Despejamos V₂:
![]()
Convertimos las unidades de temperatura:
T₁ = 273 °C + 20 °C = 293 K
T₂ = 273 °C + 45 °C = 318 K
Reemplazamos por los datos y calculamos:
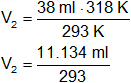
V₂ = 41,67645051 ml
Resultado, el volumen de la masa de cloro a 45 °C es:
V₂ = 41,2 ml
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP16
- | Siguiente ›
Ejemplo de cómo determinar el volumen de un gas a una temperatura dada