Problema nº 10 de ecuación general de los gases ideales, composición y presiones parciales de una mezcla de gases - TP16
Enunciado del ejercicio nº 10
En una mezcla gaseosa a 20 °C, las presiones parciales de los componentes son: 200 mm Hg de hidrógeno; 150 mm Hg de dióxido de carbono; 320 mm Hg de metano; 105 mm Hg de etileno. ¿Cuál es la presión total de la mezcla y el porcentaje del volumen de hidrógeno?
Desarrollo
Datos:
t = 20 °C
H₂ = 200 mm Hg
CO₂ = 150 mm Hg
CH₄ = 320 mm Hg
C₂H₄ = 105 mm Hg
Fórmulas:
pT = ∑pg
Solución
a)
Sumamos las presiones parciales para aplicar la ecuación de las presiones parciales de los gases:
pT = 200 mm Hg + 150 mm Hg + 320 mm Hg + 105 mm Hg
pT = 775 mm Hg
Resultado a), la presión total de la mezcla es:
pT = 775 mm Hg
b)
Armamos la tabla de contingencia:
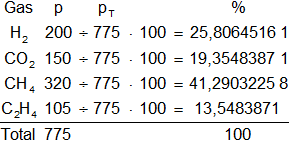
Resultado b), el porcentaje del volumen de hidrógeno es:
H₂ = 25,81 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP16
- | Siguiente ›
Ejemplo de cómo calcular la presión total de una mezcla de gases