Guía nº 12 de ejercicios resueltos de gases ideales (química)
El concepto del poder de combinación - valencia.
Resolver los siguientes ejercicios
Problema nº 1
4,25 g de un elemento X se combina para formar 5,4 g de un óxido ¿Cuál es el peso equivalente de X?
mO = 5,40 g de óxido - 4,25 g de elemento X = 1,15 g de O
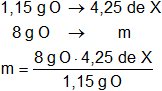
Peso equivalente de X = 29,56 g de X
Problema nº 2
Al calentar 1,08 g un óxido metálico, se descompuso dando el metal puro y 56 cm³ CNPT de O₂ ¿Cuál es peso equivalente de X?
![]()
![]()
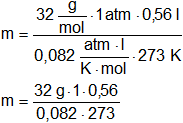
m = 0,08 g
mX = mT - m = 1,08 g - 0,08 g
mX = 1 g de elemento X

Peso equivalente de X = 100 g
Problema nº 3
2,94 g de Níquel (valencia = 2) se combina con un elemento X para formar 4,49 g de un compuesto ¿Cuál es el peso equivalente de X?
mX = 4,49 g de compuesto - 2,94 g de elemento Ni = 1,55 g de X
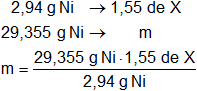
Peso equivalente de X = 15,32 g
Problema nº 4
Utilizando la tabla de pesos atómicos y valencias conocidas, hágase las conversiones siguientes:
a)
2 moles de FeCl₃ en equivalentes
6 eq FeCl₃
b)
25,6 g de Zn en equivalente
![]()
c)
13 moles de Pb en miliequivalentes
13·2 = 26 eq de Pb
d)
6,5 g de CaSO₄ en equivalentes
![]()
e)
10 l CNPT de CCl₄ gaseoso en equivalente
![]()
f)
0,45 eq de H₂S en moles
![]()
g)
0,64 eq de AlBr₃ en g
9 + 79,42 = 88,92·6,64 = 56,90 g de AlBr₃
h)
0,20 eq de CuSO₄ en g
48 + 31,77 = 79,77 = 15,95 g de CuSO₄
i)
340 cm³ CNPT de gas oxígeno (O₂) en cm³ CNPT
p·V = n·R·T
![]()
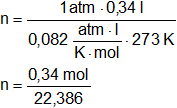
n = 0,015 = 0,03 eq O₂
j)
1,4 meq de gas Cl₂ en cm³ CNPT
1,4 meq = 0,0014 eq
0,0014·2 = 2,8·10⁻³
![]()
Problema nº 5
Utilizando el principio de equivalencia, calcular (sin ecuaciones químicas).
a)
¿Cuántos gramos de CuSO₄ reaccionarán con 2,4 g de Na₂S para producir CuS y Na₂SO₄?

b)
¿Cuántos gramos de NaOH reaccionarán con 30 g de Al₂(SO₄)₃?
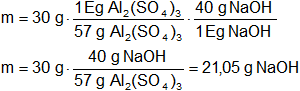
c)
¿Cuántos gramos de Ca₃(PO₄)₂ pueden prepararse a partir de 20 g de Ca(NO₃)₂ por reacción con H₃PO₄?

d)
¿Cuántos gramos de ácido sulfúrico (H₂SO₄) se necesitan para que reaccionen totalmente con 20 g de NaOH?
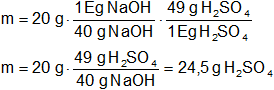
e)
¿Cuántos gramos de Zn reaccionarán con 11 g de NaOH para producir hidrógeno y cincato de sodio?
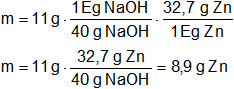
Problema nº 6
Para neutralizar 14,2 g de un ácido desconocido X se requieren exactamente 1,37 g de ácido ¿Cuál es el peso equivalente del ácido?
![]()
Problema nº 7
24,5 mmol de Ca(OH)₂ neutralizaran exactamente 1,37 g de un ácido ¿cuál es el peso equivalente del ácido?

m = 1,815205 g de Ca(OH)₂

Peso equivalente del ácido = 27,96 g/Eq
Problema nº 8
Cuando 18,7 g de un ácido desconocido reaccionen con cinc metálico se desprende exactamente 800 cm³ CNPT de H₂ gaseoso. ¿Cuál es el peso equivalente del ácido?
p·V = n·R·T
![]()
Convertimos las unidades de volumen:
V = 800 cm³ = 0,8 l
T = 273 K
p = 1 atm
R = 0,082 l·atm/K·mol
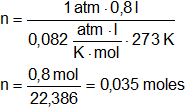
Eg = 0,035·2 = 0,0714 g
![]()
Problema nº 9
Cuando reacciona con un ácido 3,5 g de un metal desconocido se producen exactamente 250 cm³ CNPT de H₂ gaseoso. ¿Cuál es el peso equivalente del metal?
Problema nº 10
Dada la valencia del oxígeno como 2, calcúlese la valencia del otro elemento en cada uno de los siguientes compuestos:
a) N₂O ⟶ 2/2 = 1
b) NO₂ ⟶ 2·2/1 = 4
c) N₂O₃ ⟶ 3·2/2 = 3
d) P₂O₅ ⟶ 5·2/2 = 5
e) SO₃ ⟶ 3·2/1 = 6
f) CO ⟶ 1·2/1 = 2
g) Mn₂O₇ ⟶ 7·2/2 = 7
h) ClO₂ ⟶ 2·2/1 = 4
i) Tl₂O₃ ⟶ 3·2/2 = 3
j) PtO₂ ⟶ 2·2/1 = 4
k) Fe₃O₄ ⟶ 4·⅔ = 8/3
Bibliografía:
Cálculos Químicos de Benson.
Autor: Carlos Alberto Lozano Escobedo. México.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›
Problemas resuelto.