Problema nº 1 de ley de conservación de la masa - TP01
Enunciado del ejercicio nº 1
En un sistema cerrado cuya masa total es de 100 g, se hacen reaccionar 10 g de cloruro de bario (BaCl₂) con la cantidad correspondiente de ácido sulfúrico (H₂SO₄), para dar sulfato de bario (BaSO₄) y ácido clorhídrico (HCl), ¿cuál es la masa del sistema al final de la reacción?
Desarrollo
Datos:
mT = 100 g
mBaCl₂ = 10 g
Solución
Por tratarse de un sistema cerrado la masa final de la reacción debe ser de 100 g cumpliendo con la ley de conservación de la masa o la primera ley de Lavoisier.
Verifiquemos, la ecuación estequiométrica es la siguiente:
BaCl₂ + H₂SO₄ ⟶ BaSO₄ + 2·HCl
Calculamos las masas de los moles que intervienen en la reacción en equilibrio:
BaCl₂: 137,34 g + 2·35,453 g = 208,246 g
H₂SO₄: 2·1,00797 g + 32,064 g + 4·15,9994 g = 98,07754 g ≅ 98,076 g
BaSO₄: 137,34 g + 32,064 g + 4·15,9994 g = 233,4016 g ≅ 233,4 g
2·HCl: 2·(1,00797 g + 35,453 g) = 72,92194 g ≅ 72,922 g
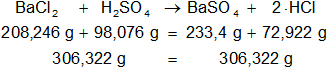
Mediante regla de tres simple calculamos que masa de ácido sulfúrico necesaria:
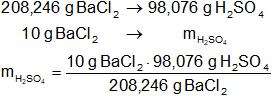
mH₂SO₄ = 4,71 g de H₂SO₄
Esto indica que hay ácido sulfúrico en exceso.
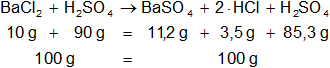
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo verificar la ley de conservación de la masa