Problema nº 1 de ley de Lavoisier y Proust, leyes gravimétricas o ponderales - TP05
Enunciado del ejercicio nº 1
Se analizaron dos muestras obteniéndose los siguientes resultados:
17 g de muestra 1: 14 g de N y 3 g de H
3,4 g de muestra 2: 2,8 g de N y 0,6 g de H
Responder:
a) ¿Se trata de muestras del mismo compuesto? ¿Por qué?
b) ¿Qué leyes se cumplen?
c) ¿Cuánto nitrógeno y cuánto hidrógeno hay en 6,8 g del mismo compuesto?
Solución
a)
Observamos que:
14 g de N + 3 g de H = 17 g
2,8 g de N + 0,6 g de H = 3,4 g
La suma de las masas de las sustancias reaccionantes es igual a la masa del compuesto producto de la reacción. Se cumple la ley de Lavoisier.
Luego, efectuamos la relación entre los mismos elementos de las distintas muestras:
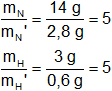
Existe una relación constante de masas. Se cumple la ley de Proust.
Sí, son muestras del mismo compuesto.
b)
Se cumple la ley de Proust y la ley de Lavoisier.
c)
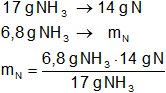
mN = 5,6 g de N
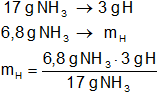
mH = 1,2 g de H
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, aplicación de las leyes gravimétricas o ponderales